原创 青白视角 Aggie 青白视角 2024-01-16 23:52 发表于新加坡
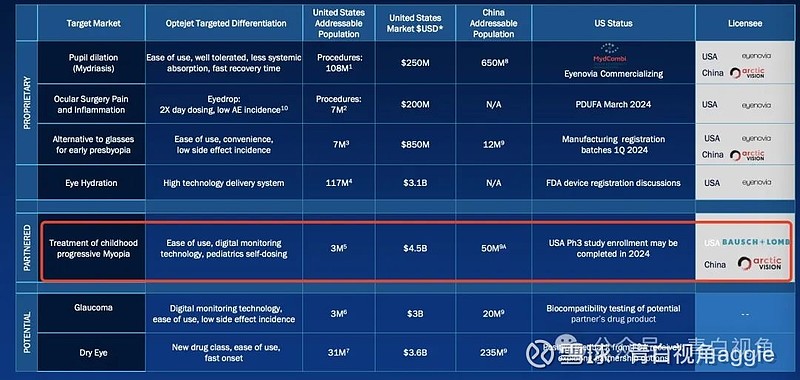
今日,Eyenovia 宣布重新获得 MicroPine 在美国和加拿大的权益。MicroPine 是一种正在研究的 8μL阿托品眼用喷雾剂,由 Eyenovia 专有的 Optejet 设备递送,正在被评估为治疗儿童进行性近视(近视进展)的潜在治疗方法。
据估计美国有超过 2500 万儿童患有近视,其中 500 万人被认为处于进行性近视的高风险中。如果不加以控制,进行性近视有可能导致严重的视力丧失和潜在的失明。先前的研究表明,阿托品可以减缓近视进展达 60%,并且尚无一款 FDA 批准的安全有效的治疗方案,存在巨大尚未得到满足的需求。
01 之前的故事
而为什么说是重新获得,2020年10月,Bausch Health宣布其附属公司Bausch + Lomb Ireland Limited已获得独家许可MicroPine在美国和加拿大开发和商业化权益。
就本次交易而言,Eyenovia 将向 Bausch + Lomb Ireland Limited 支付预付款,其中包括 200 万美元现金和 300 万美元普通股,以及在美国和加拿大销售MicroPine的低个位数净销售额分成。
02 重新收回的意义
MicroPine 将利用 Optejet分配器---使用 Eyenovia 专有的微剂量阵列打印 (MAP™) 技术水平管理眼科溶液。该系统的功能类似于喷墨打印机,通过精密喷雾提供精确的微剂量。传统眼药水约40μL的容量超过了眼睛的吸收能力(8μL),而Optejet以8μL的药物剂量喷洒在等量上,使药物和防腐剂的毒性降低80%。

该技术具有高度差异化,与传统滴眼液相比,带来了显著临床获益,包括更少的全身暴露、更好的儿童依从性、易用性以及潜在的更好的局部耐受性。
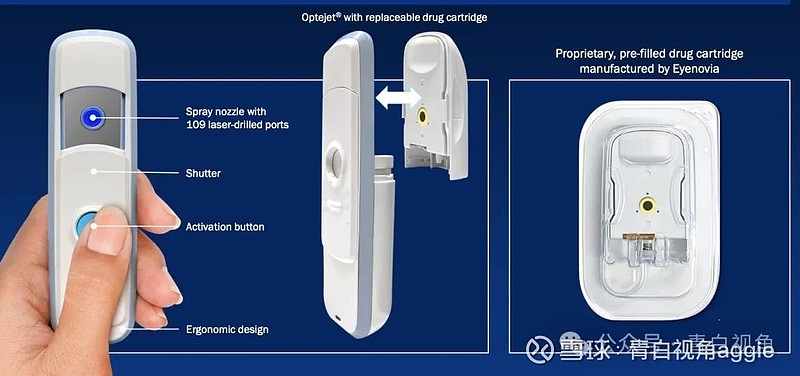

重新收购 MicroPine 极大地扩展了 Eyenovia 的 III 期产品线和商业机会,具体如下:
随着 Eyenovia 在 2024 年加速其商业能力,扩大 MydCombi 的推出以及预期推出 APP-13007(预计 3 月份等待 FDA 批准),MicroPine 在眼科巨大未满足的医疗需求市场中增加了一项主要的后期资产;
根据公司内部预测,通过收回 MicroPine 权益,Eyenovia 获得的 MicroPine 项目的整体资产价值比公司根据原始许可协议有资格获得的资产价值增加了一倍以上;
Eyenovia 将致力于加速正在进行的 CHAPERONE III 期试验,并与 FDA 合作探索加快 MicroPine 开发和注册的进程;
扩大了可以进行 CHAPERONE 研究以支持注册的领域,以及参与未来合作或战略讨论的潜在合作者领域。
03 阵营中的其他强兵与中国企业的影子
2023 年 5 月,FDA 批准了Eyenovia的MydCombi,这是首款专为散瞳设计的眼科喷雾剂。Mydcombi 是一种微剂量眼用喷雾剂,含有 1% 托吡卡胺和 2.5% 去氧肾上腺素。这标志着托吡卡胺和去氧肾上腺素的固定剂量组合药物在美国首次获得批准,也是首个使用 Optejet 眼药递送设备获得监管部门批准的药物。
2023 年 8 月,Eyenovia宣布从台塑制药获得 APP13007 的美国商业化权益。APP13007 是一种用于治疗白内障手术后炎症和疼痛的皮质类固醇丙酸氯倍他索 (0.05%) 的新型眼科纳米混悬剂。该药物利用了台塑制药独特的APNT™纳米微粒制剂技术平台。需要指出的是其大中华区及港澳市场商业化合作方是远大医药。
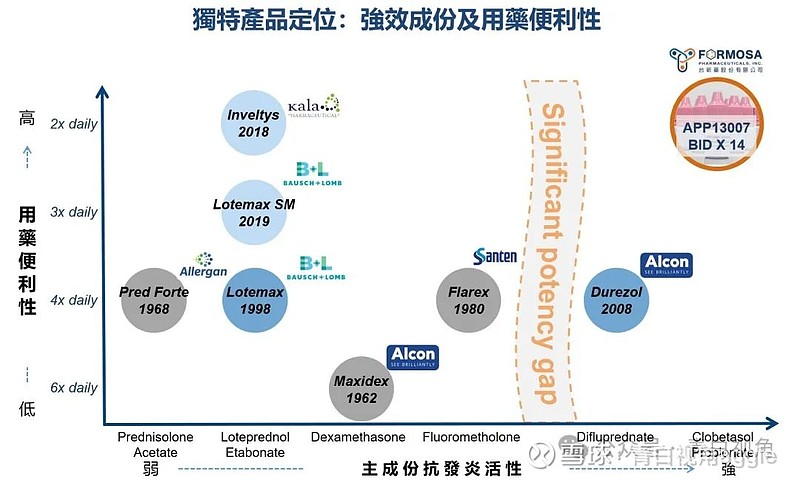
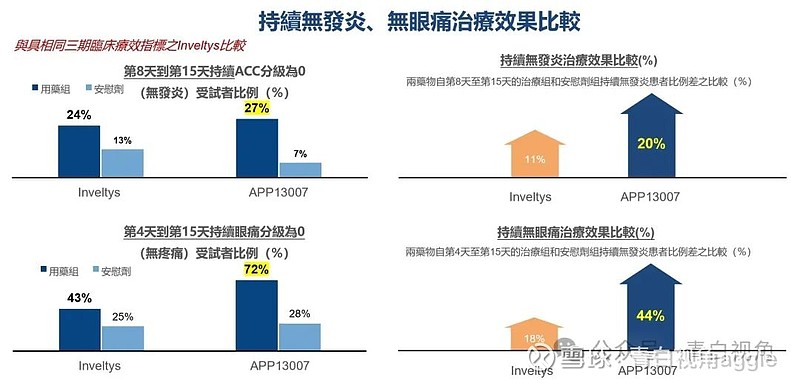
相较美国2018年上市药物Inveltys,APP13007显示了突出的疗效:持续缓解白內障术后眼部发炎及疼痛。
APP-13007 目前正在接受NDA审查,FDA 已为 APP-13007 指定了PDUFA目标行动日期为 3 月 4 日。
公司认为,MicroPine 如果获得批准,将与以上这些产品形成高度互补。重新收购 MicroPine 在美国和加拿大的权利,利用 Optejet 加速高端产品的商业化,符合该公司更广泛的企业战略。
该协议不会影响 Eyenovia 与 极目生物的持续合作关系,极目 于 2020 年 8 月从 Eyenovia 获得了ARVN002(MicroPine)治疗候选药物的许可,用于在大中华区和韩国进行开发和商业化。目前正处于临床三期。
04 不同的较量:天下武功唯快不破
值得一提的是,2023年6月,Vyluma宣布FDA已接受NVK002(低剂量阿托品 0.01%)的新药申请(NDA)审查。10月 宣布NVK002在第III期CHAMP(儿童近视进展阿托品治疗)临床研究的第二阶段取得积极的顶线结果。2020 年 10 月,兆科眼科与 Nevakar签订一项关于NVK002 的独家许可协议,兆科获得大中华、南韩及东南亚若干国家开发、制造、登记、进口及商业生产 NVK002。FDA 已指定NVK002 PDUFA目标日期为 2024 年 1 月 31 日。NVK002能否成为第一款经FDA获批的近视控制滴眼液,还有半月,我们拭目以待。