原始录音在喜马拉雅搜索,记录见附图:
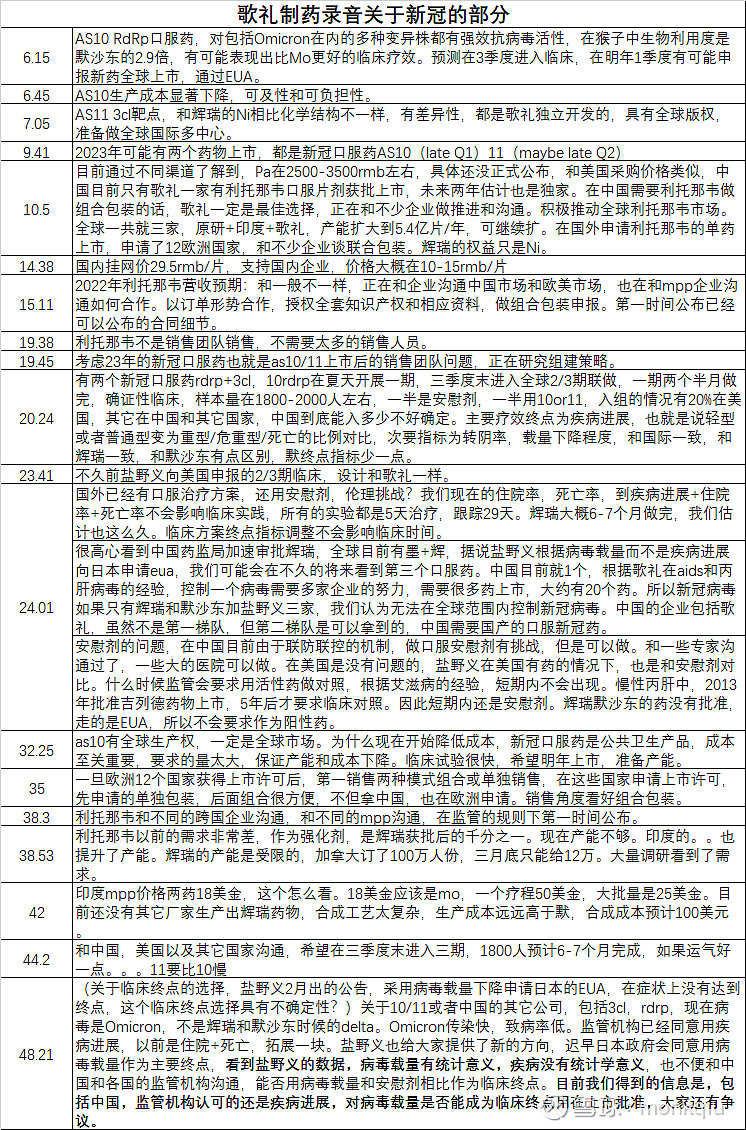
1、歌礼有两个新冠口服药as10(rdrp)+AS11(3cl),10在夏天开展一期,三季度末进入全球2/3期,p1两个半月做完,p2/3样本量在1800-2000人左右,一半是安慰剂,一半用10,入组的情况有20%在美国,其它在中国和其它国家,最快23年Q1末上市。AS11平均慢三个月左右。
2、临床试验主要终点为为疾病进展,也就是说轻型或者普通型变为重型/危重型/死亡的比例对比,次要指标为转阴率,载量下降程度,和国际一致,包括辉瑞,比默沙东多一点。
3、关于包括AS10/11或者中国的其它公司在研药物,现在病毒是Omicron,不是辉瑞和默沙东时候的delta。Omicron的特点是传染快,致病率低。监管机构已经同意用疾病进展作为临床终点,以前是重症住院+死亡。盐野义也给大家提供了新的方向,迟早日本政府会同意用病毒载量作为主要终点,看到盐野义的数据,病毒载量有统计意义,疾病没有统计学意义,也不便和中国和各国的监管机构沟通,能否用病毒载量和安慰剂相比作为临床终点。目前我们得到的信息是,包括中国,各国监管机构认可的还是疾病进展,对病毒载量是否能成为临床终点用在上市批准,大家还有争议。(备注:某抗艾药物轻症郑州300来人,靠病毒载量可以获批?)
4、根据歌礼在AIDS和丙肝病毒的经验,控制一个病毒需要多家企业的努力,需要很多药上市,艾滋病大约有20个药。所以新冠病毒如果只有辉瑞和默沙东加盐野义三家,我们认为无法在全球范围内控制新冠病毒。(备注:我一直在提的116+993的联用)
5、默沙东药物印度一个疗程50美金,大批量是25美金,辉瑞药物预计合成成本100美金。
6、预计一时半会,监管机构不会要求和辉瑞、默沙东药物头对头临床数据作为批准标准。
备注:个人感觉,116对比AS10的优势,116参照了瑞德西韦,安全性,疗效确定性比AS10要高,而且很重要的是快了许多。
$君实生物-U(SH688180)$ $歌礼制药-B(01672)$