5月29日,罗氏宣布其PI3Kα抑制剂Inavolisib(GDC-0077)的新药申请(NDA)已被FDA受理并获优先审评资格,用于联合哌柏西利和氟维司群治疗既往接受内分泌疗法辅助治疗后或完成辅助内分泌治疗后12个月内复发的PIK3CA突变、激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的局部晚期或转移性乳腺癌成人患者,PDUFA日期定为2024年11月27日。上个月,该适应症也获得了国家药监局的优先审评资格(见:罗氏PI3Kα抑制剂联合疗法拟纳入优先审评)。
此次NDA主要是基于III期INAVO120研究的积极结果。该研究是一项随机、双盲、安慰剂对照临床试验(n=325),评估了Inavolisib联合哌柏西利和氟维司群对比安慰剂联合哌柏西利和氟维司群治疗PIK3CA突变型HR+/HER2-局部晚期或转移性乳腺癌成人患者的疗效和安全性。研究的主要终点为无进展生存期(PFS)。
结果显示,与安慰剂组相比,Inavolisib组患者的中位PFS有所延长(15.0 vs. 7.3个月,HR=0.43,P<0.0001),数据具有统计学意义和临床意义;总生存期(OS)数据尚未成熟,但已观察到明显的积极趋势(NE vs. NE,HR=0.64,P=0.0338),后续将继续随访,静待下一次分析。
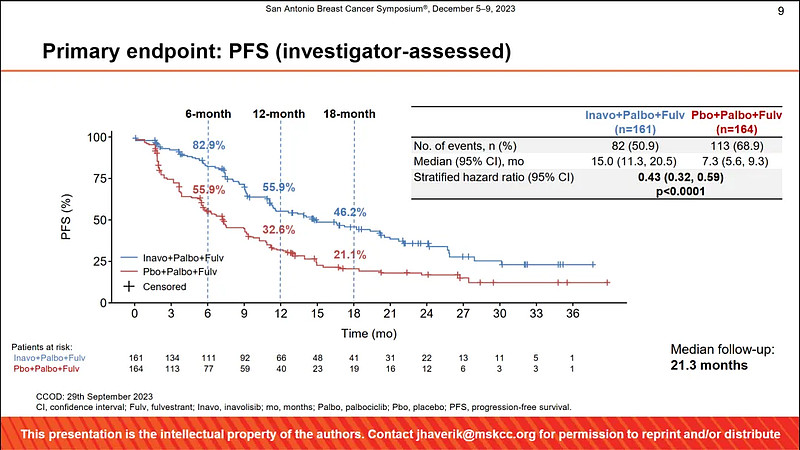
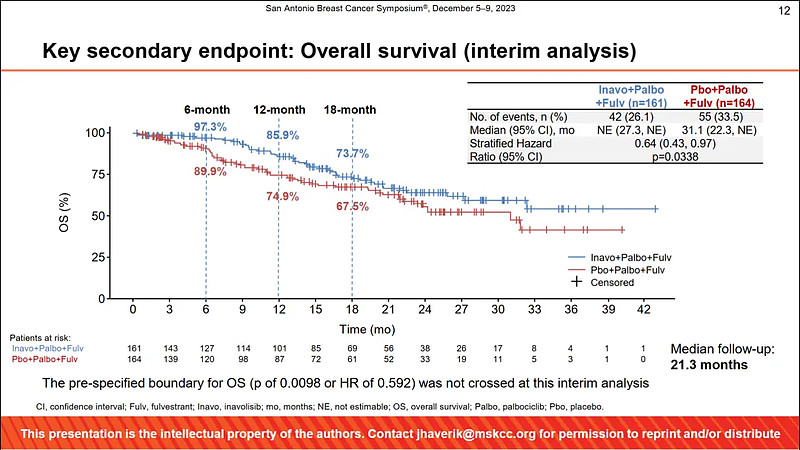
来源:SABCS 2023
大约40%的HR+转移性乳腺癌患者存在PIK3CA基因突变。该突变可导致PI3Kα蛋白突变,从而导致肿瘤生长不受控制、疾病进展和对内分泌治疗的抵抗。
Inavolisib是一款口服、高选择性PI3Kα抑制剂,对PI3Kα的选择性和效力均高于其它亚型(PI3Kβ/δ/γ)),并且能够特异性触发突变PI3Kα蛋白的降解。凭借这种独特的双重作用机制,Inavolisib可能为HR+/HER2-的PI3Kα突变型晚期乳腺癌患者提供耐受性良好、持久的疾病控制效果,并可能改善其预后。
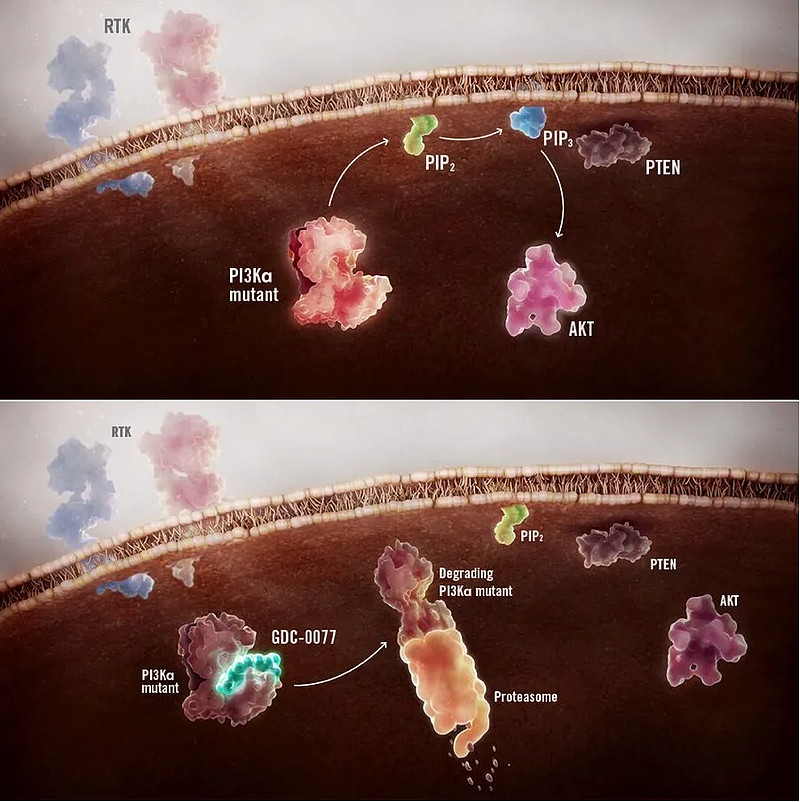
Inavolisib的作用机制(来源:Cancer Research)
除了INAVO120研究,罗氏就Inavolisib也开展了其他两项III期研究:
INAVO121研究(n=400):Inavolisib联合氟维司群 vs. 阿吡利塞联合氟维司群治疗既往接受过CDK4/6抑制剂和内分泌疗法治疗的HR+/HER2-乳腺癌患者。
INAVO122研究(n=230):Inavolisib联合帕妥珠单抗曲妥珠单抗皮下注射复方(Phesgo)vs. Phesgo作为HER2+乳腺癌患者在接受一线诱导治疗方案治疗后的维持治疗方案。
目前,全球仅阿吡利塞(诺华)一款选择性PI3Kα抑制剂获批上市。除此之外,共3款选择性PI3Kα抑制剂处于III期阶段,分别为Inavolisib、Taselisib(罗氏)和Serabelisib(Kaken/Petra Pharma),Inavolisib是其中进度最快的一款产品。
近期医药行业热门研究报告免费下载:
ASCO 2024 会议数据资料集「会前版」网页链接
ASCO 2024 重点资料汇总网页链接
2024中国合成生物学产业白皮书网页链接
医药魔方-2019-2023年创新药临床研究报告网页链接
更多相关报告和医药资讯持续更新,请持续关注医药魔方ByDrug 网页链接