2023年8月22日,诺华公司英克司兰钠注射液(商品名:乐可为®)获国家药监局批准上市,成为国内首款上市的小干扰RNA(siRNA)药物。英克司兰可通过靶向抑制PCSK9蛋白有效降低人体的低密度脂蛋白胆固醇(LDL-C)水平,其一年两针*的便捷给药方式也为血脂管理开启了新时代。据诺华2023年财报,英克司兰全年销售额已达3.55亿美元。
相关研究报告下载:
医药前沿技术行业研究:RNA疗法前景广阔,核酸药物有望开启第三代药物浪潮网页链接
由于PCSK9 siRNA可观的市场前景,不少企业纷纷在这一赛道布局并试图突破技术专利壁垒。2022年年底和2023年上半年,涉及英克司兰的两项物质组成专利先后受到第三方发起的专利无效挑战, 国家知识产权局已分别做出决定,明确认定其中一项专利(专利号:ZL201380063930.5,专利到期日:2033年12月5日)应维持全部有效,另一项专利(专利号:ZL201810143112.0,专利到期日:2033年12月5日)在修改文本的基础上应维持有效。
小干扰RNA(siRNA)是每条链包含19-25个核苷酸的双链核酸片段,可下调相应蛋白的表达[1-4]。作为全新的药物类别,siRNA的循证证据与实践经验或许还有待积累,但其所利用的RNA干扰机制早已是生命科学的重要研究领域之一。RNA干扰(RNA interference,RNAi)现象最早于1998年被发现,随后仅经过了8年时间便进入诺贝尔奖名单。然而,从“诺奖成果”到最终成功转化为一款具有里程碑意义的新药,RNAi技术走过了25年曲折起伏的探索之路。
顺风开局:RNA干扰为疾病治疗打开想象空间

科学发现常常发生在不经意的日常生活中,万有引力如此,RNAi现象也是如此。
1990年的一天,研究转基因植物的科学家Carolyn Napoli和Van der Krol往紫色喇叭花中导入了一份查耳酮合成酶的基因片段。这种合成酶是一种在植物中发现的可以控制花朵色素合成的蛋白,其表达量的改变能够影响花朵的颜色及其深浅程度。两位科学家原本预期在导入基因片段后,收获一朵颜色更深、更加鲜艳的喇叭花,结果却得到了一朵白色喇叭花[5,6]。研究者们后来发现,转基因花中查尔酮合成酶的浓度远远低于正常的喇叭花,于是推测是外源转入的基因以某种方式抑制了植物中内源基因的表达。

喇叭花实验中得到的部分表型[4]
1995年,Su Guo和Ken Kemphues发现正义链RNA(指导蛋白质合成的链)和反义链RNA(与正义链RNA序列互补的链)都可以特异性阻断秀丽隐杆线虫(Caenorhabditis elegans)par-1基因的表达[7],不过他们未能给出合理的因果关系。
这个谜题在3年后被两位充满好奇心的科学家Andrew Fire和Craig Mello解开。在一次实验中,两人将短片段的双链RNA(dsRNA)注入秀丽隐杆线虫体内,从而发现了真核生物的RNA干扰(RNAi)现象——将与mRNA对应的正义RNA和反义RNA组成的dsRNA导入细胞,可以使mRNA发生特异性的降解。这项研究成果在《Nature》杂志上一经发表,便轰动了整个科学界,因为大家看到了通过RNAi治疗疾病的希望。正如多年后诺贝尔奖委员会在官方发布中所明确指出的:“RNAi是控制遗传信息流动的根本机制,已在基础科学领域得到了广泛的应用,也将引领人们找到创新的疾病疗法。”[8]

因发现双链RNA导致的RNAi机制而获得2006年诺贝尔生理学或医学奖
在这样的氛围之下,科学家们对于RNAi的研究日渐深入。1999年,英国植物学家和遗传学家David Baulcombe在植物中发现了内源性siRNA的存在,并证明这种RNA下游产物是诱导RNAi的关键成分[9]。这是siRNA第一次浮出水面,进入世人视野。
2001年,德国马克斯普朗克研究所(Max Planck Institute)的Thomas Tuschl发现人工合成的siRNA可以通过与互补序列结合介导哺乳动物细胞的靶向基因沉默[10]。这意味着,siRNA具有靶向抑制致病基因表达,从而根除疾病的潜力。对于基因组学药物开发来说,这无疑是足以震撼产业界的重磅发现。

Thomas Tuschl团队设计的siRNA序列[10]
鉴于这一前沿成果的光明前景,Thomas Tuschl的合作者之一Philip Sharp(曾因发现断裂基因而获得1993年诺贝尔奖),立即联系了时任千禧制药(Millennium Pharmaceuticals)副总裁的John Maraganore,邀请其了解RNAi技术的最新进展。双方交流后一拍即合,几人也因此结缘。

2002年,斯克里普斯研究所(Scripps Research)的科学家Paul Schimmel和Philip Sharp一行人一起创立了Alnylam(阿里拉姆)。这个有点难念的名字,原本指代的是猎户座(ORION)腰带中最亮的中心恒星,而siRNA英克司兰用ORION命名一系列临床研究,则是后话了。

Alnylam的创始团队
Alnylam成立后,John Maraganore受邀担任新公司的CEO。作为一位生物化学和分子生物学博士,Maraganore在加入Alnylam之前,已经在制药行业积累了17年的研发经验。RNAi作为一种新疗法的潜力深深吸引了Maraganore,2002年12月,他作为Alnylam的新任CEO正式加入了这家公司。那个时候,没有人知道Alnylam会经历怎样的风雨征程,也没有人料到它会为siRNA赢得什么样的殊荣。
至暗时刻:难以突破的siRNA成药关键

2006年,Alnylam正式投入开发siRNA药物的工作中,也因此直面了siRNA成药的第一大难题——如何把siRNA递送至细胞内。
由于细胞膜的选择透过性,大分子物质无法直接通过,而siRNA分子体积大,带电性强,自然是难以透过细胞膜的。siRNA的另一递送难点在于易于生物降解,容易刺激免疫反应,在体内给药后会被迅速清除。如果不从源头上解决siRNA向靶细胞和组织的细胞质的递送,用siRNA治疗疾病只能是“镜花水月”。
所以,选择一个合适的递送系统成了siRNA成药亟待解决的关键问题。
刚开始,Alnylam的研究人员发现利用胆固醇共轭物可以实现siRNA在小鼠模型中的递送,并为此设计了一个靶向抑制肝脏载脂蛋白B(ApoB)表达的胆固醇-siRNA共轭物。这个共轭物在进入小鼠体内后的确能起到降低LDL-C的作用,但是需要在非常高的剂量(50-100mg/kg)下才能达到基因沉默效果[11,12],对于共轭物的研究不得不因此终止。
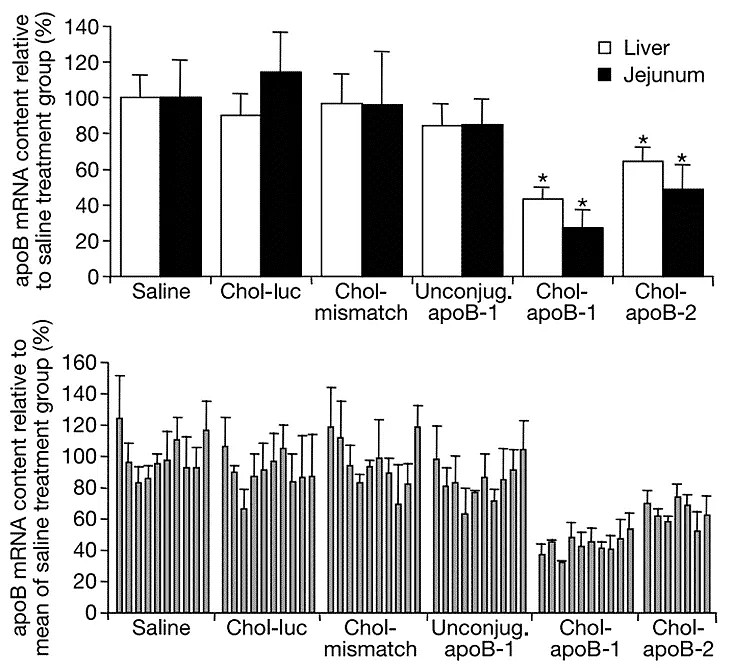
siRNA对野生型小鼠apoB mRNA的体内沉默效果[12]
“我们做了很多努力去提高它的效力,但是都失败了。”多年后,John Maraganore回忆道,“当时我们走进了一个误区,鉴于反义寡核苷酸(ASO)疗法的毒性教训,我们不敢贸然对siRNA的骨架进行修饰,所以很多偶联分子最后都被放弃了。现在想想,我们其实错过了一条让siRNA药物提前好几年上市的途径,而这些都可以归咎于自身对siRNA的认识不足和先入为主的观念。”
在那之后,研究人员又把目光转向了脂质纳米颗粒(LNP),但不论是与麻省理工学院的两位学者Bob Langer和Dan Anderson的合作[13],还是与Protiva公司的合作[11],都未能解决LNP治疗指数过窄的问题。
一路走来的诸多挫折让Alnylam有些心灰意冷,也在一定程度上打击了产业界对RNAi疗法的热情,包括默沙东、罗氏、辉瑞在内的一些大药企纷纷撤退。
征服难题:全球首创小干扰RNA降胆固醇药物诞生

但任何一个重大技术或重磅疗法的开发总是需要有人推动。重整旗鼓后,Alnylam还是决定继续攻克递送系统的难关。研究人员意识到,需要更加有效的离子化脂质体来改善LNP的效力和安全性。这一次,他们终于找到了突破口——MC3脂质体浮出了水面。与此前的脂质体相比,MC3-LNP的沉默效力提高了100倍,并且治疗指数得以扩大[14]。Alnylam最终推出了针对转甲状腺素(TTR)-介导的淀粉样变性(ATTR)的RNAi药物Onpattro(Patisiran),这款产品也成为了首个进入市场的RNAi治疗药物。

Patisiran的组成成分[15]
Alnylam 并没有因为MC3的开发而停止对于递送方法的探索。siRNA递送核心技术的关键性,促使他们继续扩大非LNP递送方法的研究工作。这一次,进入Alnylam视野的是N-乙酰半乳糖胺(GalNAc),然而基于GalNAc的共轭物开发却再度遇到了效力不足的问题,长年累月的研发投入更是让Alnylam难以为继。
最终,化学博士Muthiah Manoharan说服大家做最后一次的尝试——考虑到siRNA的不稳定性,可以通过修饰siRNA的骨架提升其稳定性,从而提高效力。“我们已经走在科学的最前沿,没有人知道所有的答案,但我想相信我的团队。”John Maraganore这样回忆当时的情景,而他的信心带来了令人振奋的结果。经过骨架修饰后的siRNA效力显著提高[16],GalNAc共轭物也因此成为所有从事RNA治疗领域公司实现肝脏递送的方式。

基于GalNAc设计的siRNA[16]
为了进一步提高siRNA的稳定性以及基因沉默效率, Alnylam开发了用于修饰siRNA序列的增强稳定化学(Enhanced Stabilization Chemistry,ESC)技术并构建了基于ESC的GalNAc递送技术平台,如今ESC已进阶为ESC+。利用ESC-GalNAc技术平台,Alnylam已成功开发3款siRNA疗法,其中最具市场潜力的便是开篇提到的英克司兰。

Alnylam的siRNA修饰技术平台[11]
英克司兰是Alnylam在常见病领域探索siRNA治疗潜力的一次尝试。2013年初,Alnylam决定为PCSK9项目寻求合作伙伴。前蛋白转化酶枯草溶菌素9(PCSK9)是“坏胆固醇”LDL-C升高的“帮凶”。PCSK9会与肝细胞表面清除LDL-C的受体结合,阻挠“坏胆固醇”的吸收。由于PCSK9主要在肝脏中表达,而Alnylam刚好拥有肝靶向递送技术——GalNAc是肝细胞的去唾液酸糖蛋白受体(ASGPR)的配体,因此其研发团队便着手设计能够抑制PCSK9表达的siRNA药物,英克司兰于是应运而生。

英克司兰的结构和作用机制[17]
2017年,英克司兰顺利完成I期临床并获得积极结果[18],随后交由合作伙伴The Medicines Company(MDCO)开发。2019年8月,英克司兰迎来高光时刻,在III期研究中大幅降低了(-50%)杂合子型家族性高胆固醇血症患者的LDL-C水平[19]。其市场潜力迅速获得了制药公司的关注,诺华在两个月后以97亿美元的金额完成了对MDCO的收购。2020年12月,英克司兰顺利在欧盟获批,并于一年后获得FDA的上市批准。
作为目前全球首款也是唯一一款降低LDL-C的小干扰RNA药物,英克司兰能从源头上阻断PCSK9蛋白合成,从而降低LDL-C水平。尤其对于他汀不耐受或者接受最高剂量他汀治疗后LDL-C水平仍然不达标的患者[20-22]而言,英克司兰无疑提供了血脂管理的全新选择。
中国速度:创新方案助力国内心血管事件拐点尽早到来

中国是成人血脂异常患病率高的大国,发生率已达到35%[23]。由于他汀类药物存在“疗效6%效应”,且大部分国人仅能接受中等剂量的他汀治疗,对于血脂控制的效果有限,患者又有用药依从性的问题,导致我国LDL-C控制水平率低。在已患动脉粥样硬化性心血管疾病(ASCVD)人群中,LDL-C达标率仅为6.8%[24]。
创新降脂药物英克司兰的出现,为更多血脂难以达标的患者带去了希望。为了能尽快将这一创新药物带入中国,诺华在中国递交并开展了两项英克司兰的注册临床试验,包括一项在中国患者中进行的PK/PD研究(ORION-14)以及一项以中国为主的亚洲患者三期研究(ORION-18)。2021年8月英克司兰在海南博鳌乐城先行区被授予试点真实世界研究。
在2023年9月召开的第34届长城心脏病学大会期间首次公布了ORION-18研究中国大陆亚组人群的数据:在他汀背景治疗的基础上,英克司兰组LDL-C从基线至第330天经安慰剂校正的百分比变化为-61.16%,且耐受性良好。在中国大陆人群中评估的疗效和安全性结果与总体人群的结果一致。
得益于国家对于创新药物审评的支持与政策扶持,英克司兰在2021年和2022年通过“先行先试”政策,落地海南博鳌乐城先行区与粤港澳大湾区,让三千位余血脂异常患者提前获益,也因此积累了英克司兰在中国患者中的真实世界数据。英克司兰海南试点真实世界研究中期数据显示,患者在接受第一针英克司兰治疗的3个月,背景降脂治疗无改变的患者平均LDL-C较基线下降可达53%,其疗效与既往的临床试验结果一致,且安全性良好。安全性方面,中国患者对英克司兰耐受性良好,没有发生导致停药的不良事件或其治疗相关严重不良事件[25]。
2023年3月,新修订的《中国血脂管理(2023版)》将英克司兰列为主要降胆固醇药物。7月,英克司兰进入了“港澳药械通”第二批新增指定医疗机构中的6家。在9月底举办的美国心脏病学会亚洲会议(ACC Asia)期间,也公布了粤港澳大湾区内香港大学深圳医院真实世界研究数据,证实了患者接受第一针英克司兰注射到3个月,具有良好的疗效和安全性结果。而在递交新药申请9个月后,英克司兰在国内获批,为科学治疗和血脂管理开创了一种更友好、便捷的全新模式。这不仅意味着临床医生能够轻松地帮助患者管理好血脂,也意味着患者能够更加便捷地享受到血脂长期达标所带来的生活质量改善。这对于减轻我国心血管疾病负担,推动心血管事件拐点早日到来无疑有重要的意义。
基于创新技术的创新药开发,难度不言自明。从科学成果到转化为一款具有突破性意义的治疗药物,siRNA技术走进过很多死胡同,但也闯开了不少新出路,不仅成就了Alnylam公司,也让RNA干扰机制治疗乃至治愈疾病的想象变成了现实。这项革命性的技术目前已经实现了从罕见病治疗到常见病治疗的“进化”,未来甚至有望拓展至肿瘤治疗领域。穿过荆棘、挺过风雨的siRNA,终将遇见它眼中有无限可能的未来。
* 使用方法:在初始治疗后三个月注射加强针,此后每年需注射两次英克司兰钠注射液。详见说明书。
参考资料:
[1] Crooke ST, Witztum JL, Bennett CF, Baker BF. RNA-Targeted Therapeutics. Cell Metab. 2018; 27(4):714-739.
[2] Dorsett Y, Tuschl T. siRNAs: applications in functional genomics and potential as therapeutics. Nat Rev Drug Discov. 2004; 3(4):318-329.
[3] Lu D, Thum T. RNA-based diagnostic and therapeutic strategies for cardiovascular disease. Nat Rev Cardiol. 2019; 16(11):661-674.
[4] Weng, et al. Biotechnology Advances 37 (2019) 801–825.
[5] Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. The Plant Cell. 1990; 2(4):279-289.
[6] Flavonoid genes in petunia: addition of a limited number of gene copies may lead to a suppression of gene expression. The Plant Cell. 1990; 2(4):291-299.
[7] par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell. 1995; 81: 611-620.
[8] 网页链接
[9] A species of small antisense RNA in posttranscriptional gene silencing in plants. Science. 1999; 286(5441):950-952.
[10] Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001; 411:494-498.
[11] Reflections on Alnylam. Nature biotechnology. 2022; 40:641-650.
[12] Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature. 2004; 432:173-178.
[13] RNAi-mediated gene silencing in non-human primates. Nature. 2006; 441:111–114.
[14] Maximizing the Potency of siRNA Lipid Nanoparticles for Hepatic Gene Silencing In Vivo. Angewandte Chemie. 2012; 51(34):8395-8664.
[15] The current state and future directions of RNAi-based therapeutics. Nature Reviews.Drug Discovery. 2019; 18(6):421-446.
[16] Multivalent N-Acetylgalactosamine-Conjugated siRNA Localizes in Hepatocytes and Elicits Robust RNAi-Mediated Gene Silencing. Journal of Medicine Chemistry. 2014; 136(49):16958–16961
[17] Oligonucleotide Therapeutics — A New Class of Cholesterol-Lowering Drugs. N Engl J Med. 2017; 376(1):4-7.
[18] A Highly Durable RNAi Therapeutic Inhibitor of PCSK9. N Engl J Med. 2017; 376(1):41-51.
[19] 网页链接
[20] Proportion of High-Risk/Very High-Risk Patients in Europe with Low-Density Lipoprotein Cholesterol at Target According to European Guidelines: A Systematic Review. Adv Ther. 2020; 37(5): 1724-1736.
[21] Nonadherence to statins: individualized intervention strategies outside the pill box. Vasc Health Risk Manag. 2018; 14: 91-102.
[22] Prevalence of the American College of Cardiology/American Heart Association statin eligibility groups, statin use, and low-density lipoprotein cholesterol control in US adults using the National Health and Nutrition Examination Survey 2011-2012. J Clin Lipidol. 2016; 10(5): 1109-1118.
[23] The prevalence, awareness, treatment and control of dyslipidemia among adults in China. Atherosclerosis. 2016; 248:2-9.
[24] 中国血脂管理指南(2023年)[J]. 中国循环杂志, 2023, 38(03): 237-271.
[25] Yong Huo, Pihua Fang, Haidong Lou,et al. Real-world early effectiveness and safety of inclisiran in China Pilot Zone: An interim analysis of 3-month data from a prospective non-interventional cohort study. Presentation at ESC Preventive Cardiology 2023.
$诺华制药(NVS)$ $瑞博生物(A04619)$ $石药集团(01093)$
更多相关报告和医药资讯持续更新,请持续关注医药魔方ByDrug 网页链接