众所周知,一款药品是存在生命周期的,一旦其专利期到期,便会面临来自仿制药或生物类似药的威胁,导致其销售额出现下滑。这也是众多药企选择多线布局以避免过分依靠一款产品来支撑整体收入的重要原因之一。
相关研究报告:2023年度中国医药专利无效报告(附详细清单)网页链接
专利链接制度下仿制药和改良型新药立项中的专利风险防范网页链接
修美乐(阿达木单抗)是近期的典型例子。2023年,修美乐正式失去市场独占权,接受来自安进、三星生物、山德士(Sandoz)等十家公司的阿达木单抗生物类似药产品的竞争。据艾伯维财报,2023年修美乐全球销售额约为144亿美元,同比下滑32%。
2024年,同样有多款产品将在美国失去市场独占权,如下表所示。
2024年失去美国独家经营权的十款产品
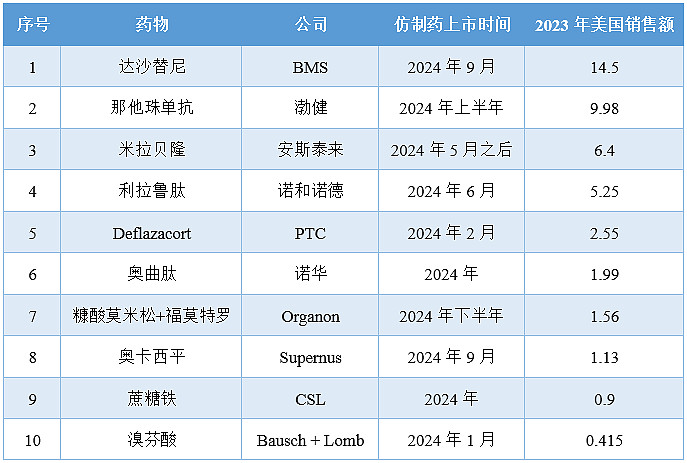
注:销售额单位为亿美元
药品:达沙替尼(Sprycel)
适应症:慢性粒细胞白血病
公司:BMS
达沙替尼是慢性粒细胞白血病(CML)领域近20年来的创新药物,为这类患者提供了显著提高其生存率的可能。根据BMS最近的一份收益报告,2023年达沙替尼的全球销售额约为19.3亿美元,其中14.5亿美元来自美国市场。
BMS曾就达沙替尼的专利纠纷进行过多次诉讼。近期,BMS在一份年度证券文件中表示,由于与Apotex以及其他公司达成和解协议,这些公司的达沙替尼仿制药被允许在2024年9月或“在某些情况下更早”上市。到目前为止,Biocon、Lupin、Dr. Reddy's Laboratories、Alebmic和Teva的达沙替尼均已获得FDA批准。
除了仿制药之外,Sprycel也面临来自剂型创新产品的威胁。例如Xspray Pharma开发了达沙替尼定形固体分散体片剂(XS004,商品名Dasynoc),该产品与Sprycel具有生物等效性,但其剂量比Sprycel低30%。Xspray Pharma表示,XS004可以通过降低剂量来减少药物副作用。FDA已于今年2月受理XS004的上市申请,并将其PDUFA日期定为2024年7月31日。
药品:那他珠单抗(Tysabri)
适应症: 多发性硬化症、克罗恩病
公司:Biogen
那他珠单抗最初于2004年被FDA批准用于治疗多发性硬化症,并在2008年扩大适应症至克罗恩病。第二年,该药物的销售额达到了11亿美元,跻身重磅炸弹药物。根据Biogen财报,2023年该药物在美国的销售额为9.98亿美元。
目前,美国仅有山德士的那他珠单抗生物类似药PB006(商品名Tyruko)获批上市。在2023年Q3财报发布会上,山德士透露计划于2024年上半年在美国和欧洲市场推出Tyruko。
药品:米拉贝隆(Myrbetriq)
适应症:膀胱过度活动症
公司:安斯泰来
米拉贝隆于2012年6月在美国获批上市。FDA的橙皮书显示,米拉贝隆的监管排他期将于2024年9月到期,其部分专利将于2024年5月到期。根据安斯泰来的财务报告,Myrbetriq在2023年的美国销售额为964亿日元(约合6.4亿美元)。
目前,Lupin和Alkem的米拉贝隆仿制药已经获得了FDA的批准,而Aurobindo的仿制产品也已申报上市。在2023年财报发布会上,Lupin首席执行官Vinita Gupta表示将在今年4-6月推出该产品。
药品:利拉鲁肽(Victoza)
适应症:2型糖尿病
公司:诺和诺德
利拉鲁肽是诺和诺德推出的第一代GLP-1产品,该产品于2010年1月在美国获批上市。自2014年以来,利拉鲁肽虽然面临来自度拉糖肽(Trulicity)的竞争,但是仍然每年为诺和诺德创造了几十亿美元的收入。2023年,该产品的美国销售额约为5.25亿美元。
目前,Teva、山德士和晖致(Viatris)等公司已对利拉鲁肽所占有的市场虎视眈眈。其中Teva计划在2024年6月将其产品推进市场。与此同时,山德士的利拉鲁肽生物类似药也被允许在今年6月22日之前或者“在某些情况下更早”上市。晖致表示,希望在与诺和诺德达成和解后在6月推出其产品。
不过,诺和诺德早已推出了第二代GLP-1产品——司美格鲁肽。该产品正在糖尿病和肥胖市场势如破竹,2023年Ozempic的美国销售额约为Victoza的17倍。
药品:Deflazacort(Emflaza)
疾病:杜氏肌营养不良症
公司:Emflaza
Deflazacort是PTC Therapeutics于2017年2月在美国推出的杜氏肌营养不良症(DMD)治疗药物。根据PTC财报,2023年Emflaza在美国的销售额为2.55亿美元。
就Deflazacort而言,PTC拥有的专利和监管排他性已经基本耗尽仅剩一个排他性尚未到期——2-5岁DMD患者,该排他性将于2026年到期。
印度公司Aurobindo的Deflazacort仿制药已在今年2月获得FDA批准,适用人群为5岁以上DMD患者。
药品:奥曲肽(Sandostatin)
适应症:肢端肥大症,类癌瘤引起的严重腹泻
公司:诺华
奥曲肽早在1988年便已在美国上市。但是,诺华后来推出了复杂剂型版本Sandostatin LAR,极大地延长了该产品的生命周期。诺华首席财务官Harry Kirsch在2023年财报发布会上表示,Sandostatin LAR是一种非常难以生产的产品,对仿制药生产商的生产能力要求极高。这便是多年来奥曲肽的市场地位无法被撼动的关键原因。
不过,今年晖致希望改变这种状况。晖致总裁Rajiv Malik在1月份的JP摩根大会上表示,将在今年推出Sandostatin LAR的仿制药。目前其仿制药的上市申请正在接受FDA的审查。
虽然Sandostatin LAR此前一直保持着美国的独家经营权,但其销售额已逐年大幅下降。去年Sandostatin在美国的销售额为1.99亿美元,同比下降2%。
药品:糠酸莫米松+福莫特罗(Dulera)
适应症:哮喘
公司:Organon
Dulera曾被认为是潜在的重磅炸弹,于2010年在美国获批用于治疗哮喘。不过,其慢性阻塞性肺病(COPD)适应症未能获批,导致其市场空间被压缩。
2015年,该产品的全球销售额达到了5.36亿美元。然而,来自葛兰素史克(GSK)的竞品Breo(糠酸氟替卡松+维兰特罗)加入了市场竞争,凭借哮喘和COPD两大适应症成为了轰动一时的药物。不过,去年Dulera的全球销售额有所回升,约为1.94亿美元,同比增长8%。
Dulera已于2020年失去了在美国的专利保护,但至今未有相关仿制药上市。
印度仿制药巨头Lupin曾于2020年4月向FDA递交了Dulera仿制药的上市申请,但其申请在2022年底被FDA拒绝批准。上个月,该公司表示将在2024年5月之前对FDA的决定做出回应。
药品:奥卡西平缓释片(Oxtellar XR)
适应症:癫痫
公司:Supernus
奥卡西平缓释片(OxtellarXR)是Supernus推出的抗癫痫药物,于2012年被批准为癫痫患者的辅助疗法。不过,其销售表现平平,在被批准为单药疗法后三年其年销售额才达到1亿美元。2023年,该产品的销售额也仅为1.134亿美元。因而,失去Oxtellar XR的专利保护对Supernus的业绩影响并不大。
在2月份的2023年财报发布会上,Supernus首席执行官Jack Kattar表示,奥卡西平缓释片的仿制药可能要到9月才开始加入市场竞争。
Oxtellar XR第一次面临仿制药的威胁是在近十年前。当时,Actavis和TWi Pharma与Supernus均展开了专利诉讼,最后Supernus胜诉,Oxtellar XR的专利保护期得以维持到2027年。
然而,Supernus在2020年与Apotex在侵权案件中败诉。去年6月,Supernus不得不与Apotex达成和解,同意后者于今年9月1日开始销售奥卡西平缓释片的仿制产品。该仿制药已于去年7月获FDA批准上市。在与Apotex达成和解之前,Supernus还对RiconPharma提起过诉讼,最终Supernus也未胜诉。
Supernus的另一款抗癫痫药物托吡酯缓释片(Trokendi XR)也于2023年遭受了仿制药的冲击。为缓解这两款抗癫痫产品到达专利悬崖的难题,Supernus在2021年以4亿美元收购了Adamas,获得了治疗左旋多巴诱导运动障碍以及多发性硬化症行走障碍的Gocovri以及用于左旋多巴诱导运动障碍的Osmolex。其中,Gocovri在2023年为创造了1.2亿美元的收入。
药品:蔗糖铁(Venofer)
适应症:慢性肾病患者缺铁性贫血
公司:CSL
蔗糖铁是CSL在2021年底以117亿美元收购Vifor Pharma时获得的产品之一。根据CSL的投资者报告,该药物在2023年的全球销售额为1.8亿美元。CSL未按地域统计药物收入,不过,按以往表现可推测其美国销售额约为0.9亿美元。
与奥曲肽类似,蔗糖铁的专利早已过期,但因制剂复杂性而获得了较长时间的市场独占期。晖致亦相信可以在2024年改变这种状况。目前,该公司开发的蔗糖铁仿制药正在接受FDA的监管审查,有望成为首款蔗糖铁仿制药。
药品:溴芬酸(Prolensa)
适应症:白内障手术后的术后眼部炎症
公司:Bausch+Lomb
溴芬酸最初由日本公司Senju开发,并于2000年在日本上市。其美国权益于2002年被ISTA(现已被Bausch+Lomb收购)收入囊中。三年后,该产品在美国获批上市,商品名为Xibrom(溴芬酸0.09%),作为白内障手术后眼部炎症的每日2次滴眼液选择。2010年,ISTA开发的溴芬酸的每日1次滴眼液版本Bromday获批上市。
2013年,溴芬酸的另一款每日1次滴眼液版本Prolensa(溴芬酸0.07%)获批上市。根据美国证券交易委员会(SEC)的一份年度文件,去年Prolensa的销售额约占Bausch+Lomb整体收入的1%。
在Prolensa获得FDA批准的同一年,Lupin曾向FDA提交溴芬酸的仿制药上市申请,但被Bausch+Lomb和Senju起诉,引发了30个月的中止期,阻止了Lupin仿制药的批准。去年11月,该仿制药终于获FDA批准。
除了Lupin之外,Metrics、Innopharma、Apotex和Paddock也向FDA提交了Prolensa的仿制药上市申请。
参考来源:The top 10 drugs losing US exclusivity in 2024. FiercePharma.
$百时美施贵宝(BMY)$ $安进(AMGN)$ $诺华制药(NVS)$
更多相关报告和医药资讯持续更新,请持续医药魔方ByDrug 网页链接