2月23日,再生元/赛诺菲共同宣布,FDA已受理度普利尤单抗(Dupixent)的第6个潜在新适应症上市申请,并获FDA优先审评,作为某些未控制的慢性阻塞性肺病(COPD)成人患者的附加维持治疗。PDUFA日期为2024年6月27日。如果获得批准,度普利尤单抗将成为COPD的唯一生物疗法,也是十多年来第一种针对该疾病的新治疗方法。中国和欧盟的监管申请也在审查中。
度普利尤单抗注射液药品信息网页链接
度普利尤单抗注射液说明书网页链接

COPD是一种非常常见的慢性气道疾病,目前尚无治愈办法,仅可通过药物治疗以缓解症状。对于病情不太严重的COPD患者来说,仅使用一种支气管舒张剂(β2受体激动剂、抗胆碱能药物、茶碱类药物)即可达到治疗目的;但是病情严重的患者通常需要联用两种以上的药物才可以改善症状。
此次新适应症上市申请主要基于BOREAS和NOTUS这两项III期研究。2023年3月,III期BOREAS研究传来捷报,度普利尤单抗成为了首个证明对COPD患者有显著临床获益的生物制剂。
BOREAS是一项随机、双盲、安慰剂对照的III期研究,旨在评估度普利尤单抗在伴发气道疾病2型炎症的中重度COPD患者中的疗效、安全性和耐受性。该研究共纳入939例40-80岁患者,他们每两周随机接受度普利尤单抗或安慰剂治疗,同时联用吸入皮质类固醇(ICS)、长效β受体激动剂(LABA)和长效毒蕈碱拮抗剂(LAMA)三联治疗。
BOREAS研究的主要终点为52周内中重度COPD的急性发作率。关键次要终点包括12周和52周时肺功能的基线变化(通过支气管扩张剂前FEV1评估)、第52周时圣乔治呼吸问卷(SGRQ)总分变化、第52周时SGRQ改善≥4分的患者比例以及第52周时ERS: COPD量表症状评分的变化。
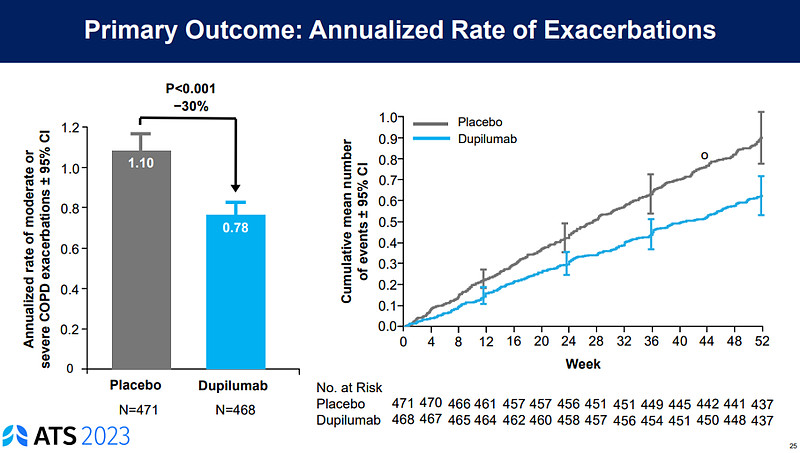
数据显示,BOREAS研究达到了主要终点,即52周内中重度COPD的急性发作减少了30% (p=0.0005)。与此同时,第12周时Dupixent治疗组患者FEV1较基线提高160mL,而安慰剂组对应数值为77mL (p<0.0001)。此外,BOREAS研究治疗达到了所有次要终点。
2023年11月,度普利尤单抗治疗COPD的第2项III期NOTUS研究也收获成功,达到了主要及关键次要终点。
NOTUS研究是旨在评估度普利尤单抗在目前接受最大标准吸入治疗(三联治疗)且伴发2型炎症(血液嗜酸性粒细胞≥300个/μL)的成年COPD患者的疗效、安全性和耐受性。该研究纳入的935例患者年龄分布在40-85岁,且当前或曾经吸烟。
结果显示,度普利尤单抗治疗组52周内中重度COPD的急性发作减少了34% (p=0.0002)。第12周时,度普利尤单抗治疗组患者肺功能较基线提高139mL,而安慰剂组对应数值为57mL(p=0.0001),益处持续到第52周(度普利尤单抗组为115mL,安慰剂组为54mL, p=0.0182)。
更多相关报告持续更新,请持续医药魔方ByDrug 网页链接