8月11日,华东医药在《关于全资子公司与 Arcutis 公司签署产品独家许可协议的公告》中,透露“与参股企业荃信生物合作开发的乌司奴单抗生物类似药HDM3001已正式递交生物制品许可申请(BLA)申请”。这意味着,HDM3001有望成为国内首款上市的乌司奴单抗生物类似药。

在该公告中,华东医药也表示“从Kiniksa引进的全球创新产品利纳西普在国内被列入《临床急需境外新药名单(第一批)》,并计划于2023年在中国正式递交冷吡啉相关的周期性综合征(CAPS )BLA申请 ”。
在自身免疫领域,华东医药还搭建了外用制剂平台,其在研产品“他克莫司软膏上市申请已于2022年4月获得受理, 并于2023年4月完成发补资料提交,有望于今年获批上市;夫西地酸乳膏上市申请于2023年5月获得受理。”

分别来看,乌司奴单抗是一款靶向IL-12和IL-23共有的p40亚基的单克隆抗体。原研产品由强生开发,于2017年11月在中国获批上市,用于对环孢素、甲氨喋呤或PUVA(补骨脂素和紫外线A)等其他系统性治疗不应答、有禁忌或无法耐受的成年中重度斑块状银屑病患者。2020年3月,乌司奴单抗获批新适应症,用于对传统治疗或TNFα拮抗剂应答不足、失应答或无法耐受的成年中重度活动性克罗恩病患者。
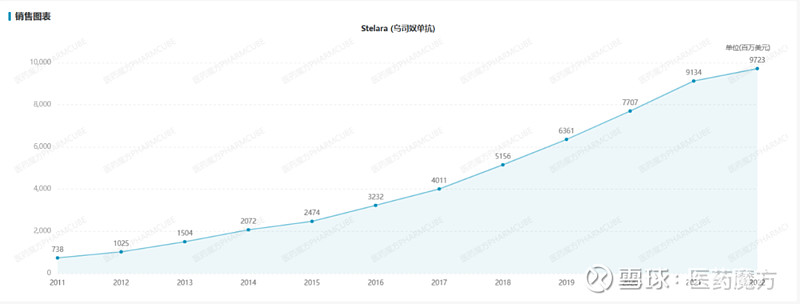
乌司奴单抗也是自免领域第二大强势品种,常年稳居自免TOP榜单第二。2022年,乌司奴单抗市场表现也是异常强劲,全球收入逼近百亿美元营收(97.23亿美元),成为强生销量最高的产品。2023上半年,乌司奴单抗创收52.41亿美元(+7.2%),有望在年底跻身百亿美元俱乐部。不过,该药物在美国的专利将在今年9月到期。
2020年8月 ,华东医药全资子公司中美华东与荃信生物共同签订了相关股权投资协议和产品合作开发协议。根据股权投资协议约定,中美华东通过增资形式出资37000万元对荃信生物进行股权投资,投资完成后持有其20.56%股权,成为其第二大股东;根据产品合作开发协议,双方将就HDM3001在中国大陆境内进行合作开发和商业化,并在产品上市后按照协议约定分享收益。
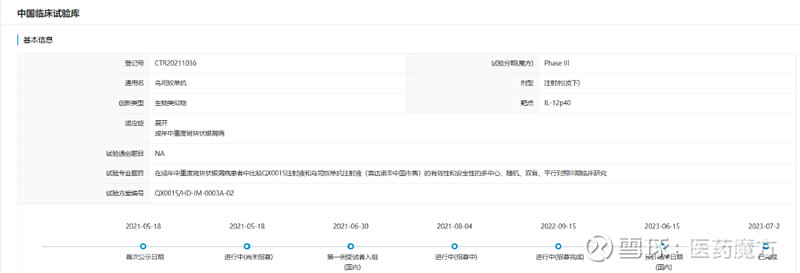
根据医药魔方数据库,HDM3001已于今年7月完成一项多中心、随机、双盲、平行对照的III期研究(CTR20211036),旨在成年中重度斑块状银屑病患者中比较HDM3001和乌司奴单抗原研的有效性和安全性。
另一款产品利纳西普是一款重组二聚体融合蛋白,可阻断IL-1α和IL-1β的信号传导。这款药最早由再生元研发,2008年2月获得FDA批准用于治疗CAPS。2017年9月,Kiniksa与再生元达成合作,获得了利纳西普的开发权益。2021年3月,Arcalyst再添复发性心包炎新适应症,成为FDA批准的首款适用于12岁及以上人群复发性心包炎的药物。
2022年2月,华东医药与Kiniksa达成独家许可协议,获得利纳西普和CD116单抗mavrilimumab在中国、韩国、澳大利亚、新西兰、印度等24个亚太国家和地区(不含日本)的开发、注册及商业化权益。根据协议,华东医药将向Kiniksa支付2200万美元首付款,最高不超过6.4亿美元的开发、注册及销售里程碑付款,以及分级两位数的净销售额提成费。
2023年1月,利纳西普获CDE授予优先审评,用于治疗成人和12岁及以上青少年CAPS,包括家族性寒冷型自身炎症综合征(FCAS)、Muckle-Wells综合征(MWS)。