7月17日,Alnylam公布了ALN-APP正在进行的I期研究单次剂量递增部分的最新中期阳性结果,该研究旨在评估ALN-APP用于治疗阿尔茨海默病和脑淀粉样血管病(CAA)的安全性、耐受性以及疗效。
点击下载:引领现代制药的第三波浪潮,小核酸药物带来全新治疗范式

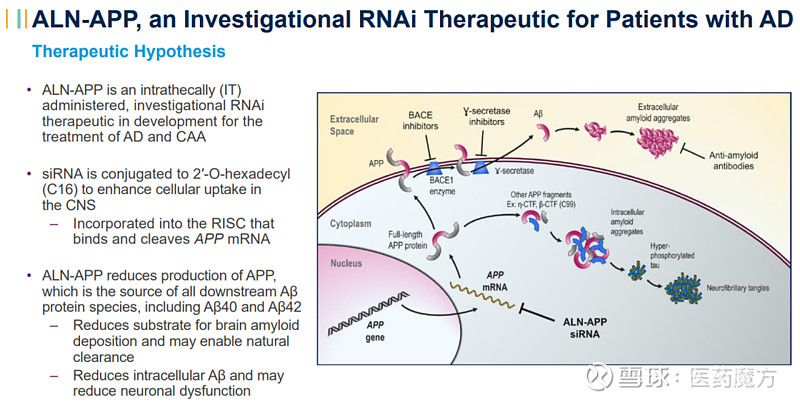
ALN-APP是一款鞘内给药的靶向淀粉样前体蛋白(APP)的RNAi疗法,也是首个利用Alnylam的C16-siRNA偶联平台开发的用于中枢神经系统(CNS)递送的临床阶段项目,该技术能够增强药物在中枢神经系统细胞的传递,从而为阿尔茨海默病和脑淀粉样血管病变提供潜在新的治疗选择。ALN-APP将由Alnylam和再生元共同开发。
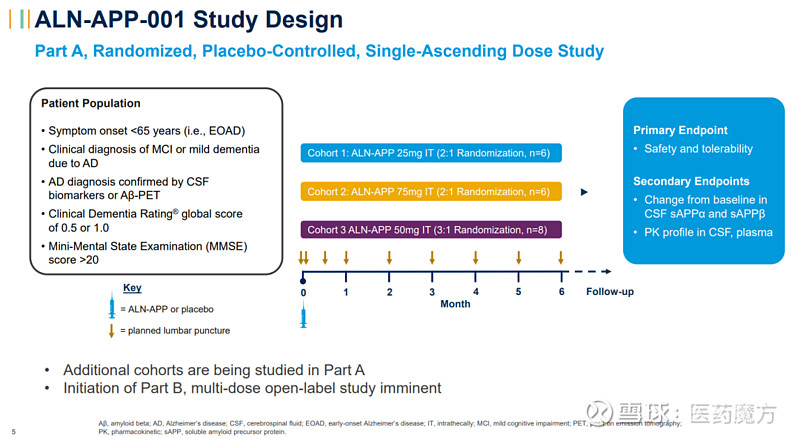
20例早发性阿尔茨海默病患者被纳入正在进行的I期研究Part A的3个单剂量队列。迄今为止,在本研究中,鞘内注射单剂量ALN-APP的耐受性良好。所有不良事件的严重程度均为轻度或中度。
脑脊液(CSF)白细胞计数和总蛋白水平较基线无显著升高。常规实验室评估(血液学、血清化学、肝功能、尿液分析、凝血)以及探索性生物标志物神经丝轻链(NfL)的初步数据未显示任何显著异常。
接受单剂量75mg ALN-APP治疗的患者脑脊液中可溶性APPα(sAPPα)和可溶性APPβ(sAPPβ)(靶标参与的生物标志物)均快速持续减少,最大降幅分别为84%和90%。单次给药后6个月,sAPPα和sAPPβ的平均降幅分别大于55%和65%。
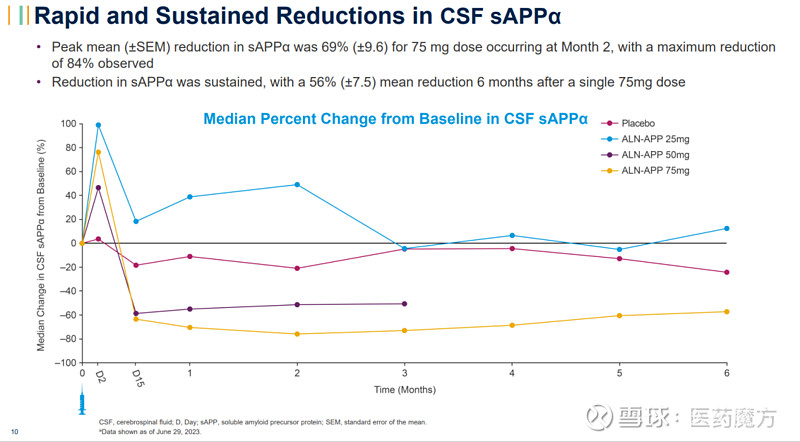
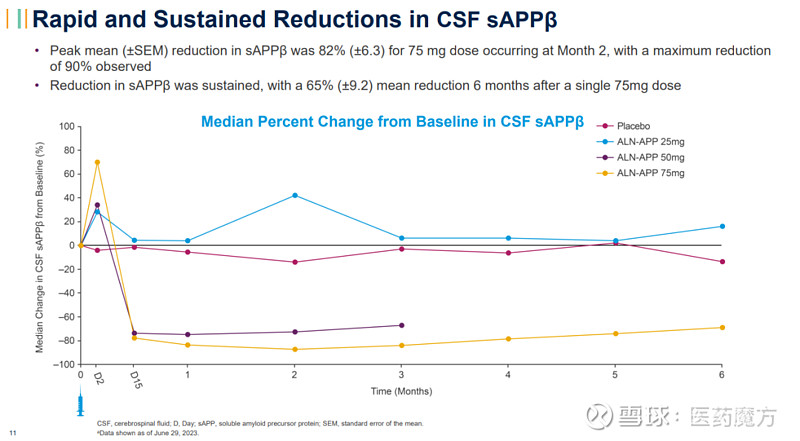
这些I期试验结果表明,单剂量ALN-APP可以迅速减少APP的产生,并且这种效果可以持续6个月。Part A正在进一步探索单剂量ALN-APP,此外,安全性审查委员会建议启动Part B,即该研究的多剂量部分。Part B将招募来自Part A的患者,并且已经在加拿大获得了监管部门的批准。由于之前在非临床慢性毒理学研究中观察到的结果,该研究的多剂量部分在美国仍处于部分临床暂停。