抗体偶联药物(ADC)的浪潮愈演愈烈,无论是跨国大药企还是biotech,都已经拿起冲浪板“get in the water”。不过相较于资金有限、靠技术平台从头开始自主研发的biotech来说,资金充裕的MNC往往能更加从容地选择自研、授权合作或直接豪掷重金收购公司以获得它们心仪的ADC项目。
艾伯维是最早入局ADC赛道的制药巨头之一,其布局动作最早可以追溯到2008年(彼时AbbVie尚未从Abbott中分拆出来)。不过,在此后的很长一段时间里,艾伯维在ADC领域一直毫无建树。直到2016年,艾伯维以58亿美元首付款收购了Stemcentrx,获得了后者的核心资产——一款靶向Delta样配体3(DLL3)的ADC药物Rova-T,一时间也让艾伯维在ADC领域声名鹊起。
DLL3被认为是小细胞肺癌(SCLC)靶向治疗极具潜力的靶点,SCLC领域极大的未满足临床需求也让业内对艾伯维重金豪掷的Rova-T期待值拉满。然而,Rova-T的失败接踵而至,艾伯维也在2019年彻底停止了Rova-T的开发。这对艾伯维来说是一个不小的打击,Rova-T的失败不仅让58亿美元的首付款打了水漂,也一定程度打乱了其转型拓展肿瘤业务的节奏。
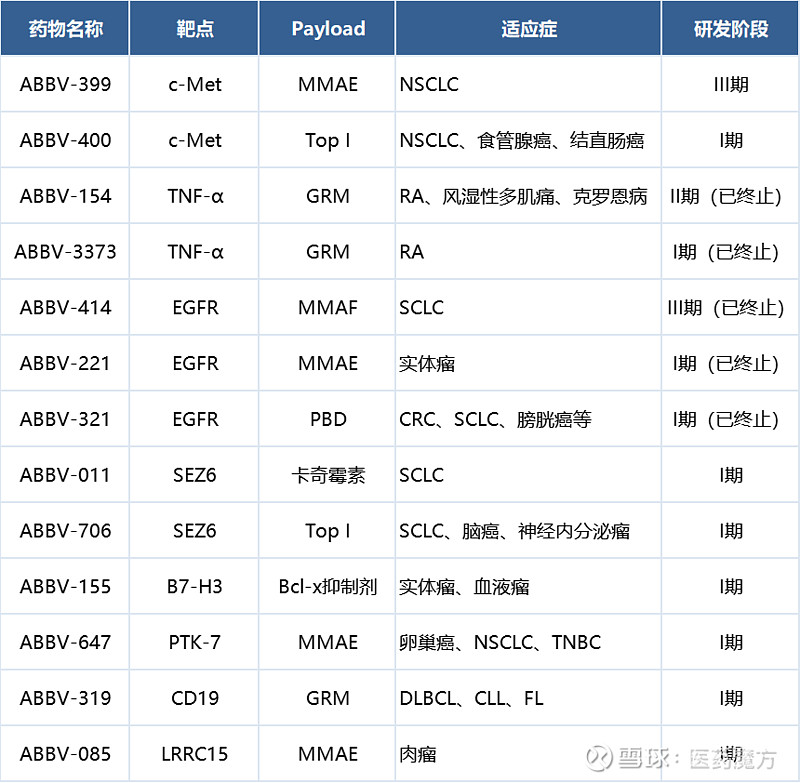
从2008年布局ADC至今,15年的时间里,艾伯维可以说是见证了ADC技术成长与进步的全过程,同时也在不断的探索、试错中越来越接近正确答案。目前,艾伯维已成功搭建起了自研ADC管线,临床阶段的在研ADC项目达到8款,进展最快的c-Met ADC ABBV-399已进入全球注册性III期临床。
艾伯维临床阶段的ADC项目
EGFR ADC的磨砺
EGFR为表皮生长因子受体(HER)家族成员之一,具有酪氨酸激酶活性,其与EGF结合后可通过多条信号通路促进细胞分裂与增殖。EGFR在肺癌、胃癌、乳腺癌、膀胱癌等实体瘤中高度表达,这也让EGFR成为了肿瘤靶向治疗的热门靶点。 在EGFR TKI、EGFR单抗相继出现耐药问题后,ADC也开始下场挑战EFGR靶点。
早在2008年,雅培与Life Science Pharmaceuticals达成了一项合作协议,获得了后者4款靶向EGFR产品的全球开发和商业化许可权益,其中便包括了两款EGFR ADC——ABBV-321(serclutamab talirine)和ABBV-414(depatuxizumab mafodotin,ABT-414)。
ABBV-414由靶向表皮生长因子受体III型突变体(EGFRVIII)单抗ABT-806和毒素MMAF通过不可切割的马来酰亚胺己基(mc)连接子(linker)偶联而成,DAR值为4。
EGFRvIII在25%~30%的胶质母细胞瘤(GBM)患者中高度表达,而人体正常细胞不会表达EGFRvIII。这意味EGFRvIII有潜力成为被精准“打击”的GBM治疗靶点,且潜在副作用安全可控。正是基于此,艾伯维开展了ABBV-414一线治疗GBM的临床研究,并在2014年获得了EMA和FDA授予的孤儿药资格。
2019年5月,艾伯维公布了ABBV-414一线治疗EGFR阳性GBM的III期INTELLANCE-1研究的中期分析结果。然而,相比于安慰剂+标准治疗(放疗+替莫唑胺),接受ABBV-414+标准治疗的患者没有获得生存期方面的获益。因此,独立数据监测委员会建议该研究提前终止,艾伯维也随即终止了ABBV-414的临床开发计划。
ABBV-414的临床失败并没有浇灭艾伯维对EGFR ADC的期待。在ABBV-414的临床研究中,艾伯维观察到了该药物引发的眼部毒性,推测其可能与MMAF毒素相关。初代产品的不完美也驱动着艾伯维针对EGFR ADC的继续探索。
ABBV-221是艾伯维自主研发的第二代EGFR ADC,与ABBV-414相比,ABBV-221在抗体、毒素、linker三部分都进行了优化:①ABBV-221的抗体部分AM1非选择性靶向EGFRvIII,其可以结合野生型EGFR(EGFRwt)和EGFRvIII,提高了ABBV-221对EGFR靶点的亲和力;②为了规避眼部毒性,ABBV-221的毒素部分替换成了MMAE;③ABBV-221的DAR值也降低为3[1] 。不过,ABBV-221在治疗实体瘤的I期研究中却显示出了不及预期的疗效与安全性,艾伯维随即也终止了该项目的研发计划。
同为2008年引进的ABBV-321是由可结合EGFRwt和EGFRvIII的AM1单抗和毒素PBD通过可降解的MC-Val-Ala连接而成,DAR值为2。然而,目前艾伯维的研发管线中已看不到ABBV-321的身影。不难理解,面对ABBV-414和ABBV-221的接连失利,艾伯维不得不更谨慎的对待EGFR ADC的研发布局。
c-Met ADC的首发潜力
c-Met/HGF信号通路的异常激活与NSCLC的发生发展以及EGFR-TKI的耐药性密切相关。目前已有多款小分子c-Met抑制剂获批用于治疗c-Met突变和过度扩增的NSCLC,但这类药物存在的耐药性问题明显缩短了患者的响应时间。
相对于小分子,靶向性的c-MET单抗与HGF的结合能力会更强,理论上治疗效果也会更加显著。然而,针对c-MET的单抗研发并不顺利,目前还没有任何一款c-MET单抗获批上市,罗氏的Onartuzumab、安进的Rilotumumab先后折戟于此。面对c-MET药物领域存在的机会,艾伯维则另辟蹊径,选择从ADC下手。
ABBV-399(telisotuzumab vedotin)是艾伯维自主研发的候选药物,其由抗c-Met人源化单抗ABT-700和毒素MMAE通过可裂解的二肽VC偶联而成,DAR值为3.1。值得一提的是,ABBV-399是目前全球唯一一款进入III期临床的c-Met靶向ADC,同时也是艾伯维管线中进展最快的ADC项目。
ABBV-399在早期临床前细胞和动物模型中显示出了有效的抑制肿瘤生长作用,艾伯维也在2014年就启动了ABBV-399治疗NSCLC的I期临床,而当时只有辉瑞的克唑替尼和武田的卡博替尼两款非选择性的小分子c-MET抑制剂获批上市。
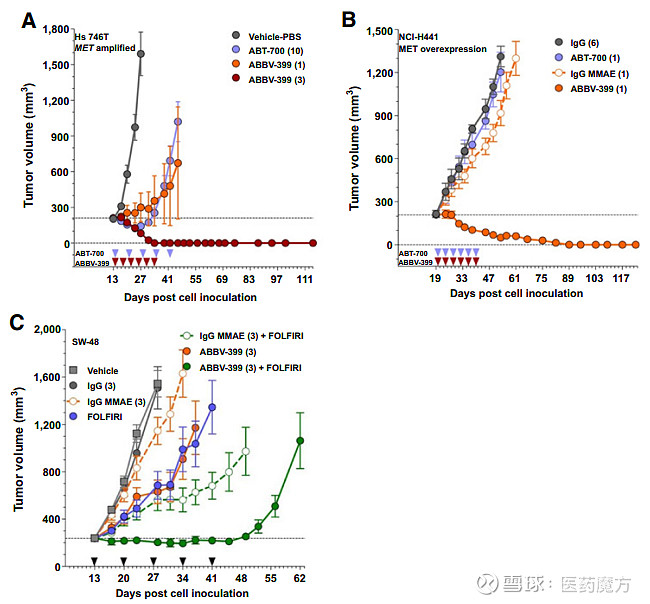
ABBV-399临床前数据(参考文献[2])
2022年1月,ABBV-399被FDA授予了突破性疗法资格,用于治疗晚期或转移性铂类治疗后进展的c-Met高表达EGFR野生型非鳞状NSCLC患者。2022 ASCO大会披露的II期LUMINOSITY研究结果显示,ABBV-399在c-Met高表达、EGFR野生型非鳞状NSCLC患者中的客观缓解率(ORR)为52.2%,在c-Met中等表达的EGFR野生型非鳞状NSCLC患者中的ORR为24.1%。
基于积极的II期数据,艾伯维已于2021年9月启动了ABBV-399治疗NSCLC患者的III期M18-868研究,旨在评估ABBV-399联用多西他赛,在既往接受过治疗的c-Met高表达EGFR野生型局部晚期/转移性NSCLC患者中的疗效和安全性。
或许在ABBV-399身上看到了c-MET靶点的潜力,艾伯维又布局了第二代c-MET ADC ABBV-400。与ABBV-399不同之处在于,ABBV-400毒素选择了Top I抑制剂,主要针对c-MET中~高表达患者。目前,ABBV-400已进入I期研究(NCT05029882),旨在评估该药物治疗晚期实体瘤患者的疗效与安全性。
目前c-Met ADC开发还处于较早期阶段。据医药魔方数据库显示,全球共9款c-Met ADC进入临床阶段除ABBV-399和荣昌生物处于II期临床的RC-108外,其余c-Met ADC均处于I期阶段。
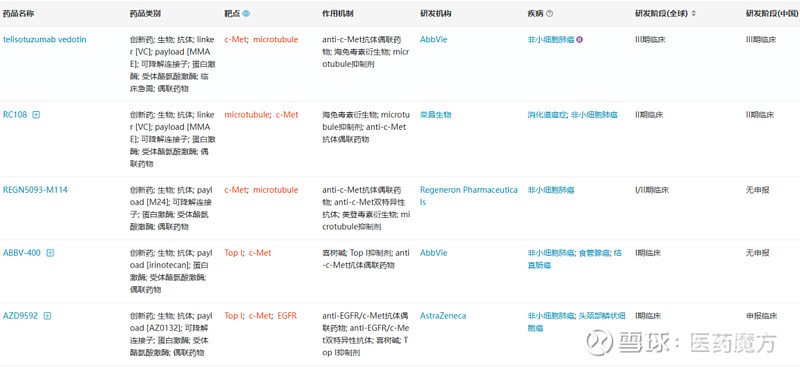
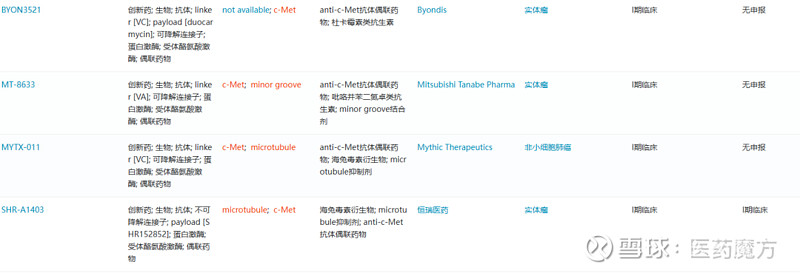
已进入临床阶段的c-Met ADC项目
值得注意的是,ABBV-399的III期M18-868研究预计将于2025年6月完成。 如若该研究取得积极结果,这不仅意味着艾伯维有望率先敲开c-MET ADC的大门;更深层面的意义在于,这也将是其ADC研发实力的最好证明。
自免ADC的机遇与挑战
自免是艾伯维的王牌业务。艾伯维不仅缔造了销售额超200亿美元神话的药王Humira(阿达木单抗),后备管线中还有增势强劲的JAK抑制剂Rinvoq和IL-23单抗Skyrizi。
不过为了应对阿达木单抗专利到期的问题,艾伯维也提前准备了二代方案——基于TNFα抗体的自免ADC(iADC),即在阿达木单抗的基础上偶联小分子激素,通过抗体定向将激素输送到炎症组织发挥作用。
ABBV-3373是艾伯维在自免ADC领域的初试水。该药物由阿达木单抗和新型糖皮质激素受体调节剂(GRM)组成,旨在通过将有效载荷GRM直接传递到表达TNFα的活化免疫细胞中,进而调节TNF介导的炎症途径。艾伯维于2019年1月启动了ABBV-3373用于治疗中重度类风湿性关节炎(RA)的II期M16-560研究。
2020年6月,艾伯维公布了M16-560研究的积极结果。相较于阿达木单抗对照组,ABBV-3373治疗组从基线至第12周主要终点DAS28-CRP变化具有统计学意义上的明显改善;安全性方面,ABBV-3373治疗组的AE发生率低于也阿达木单抗治疗组(35% vs 71%)[3]。
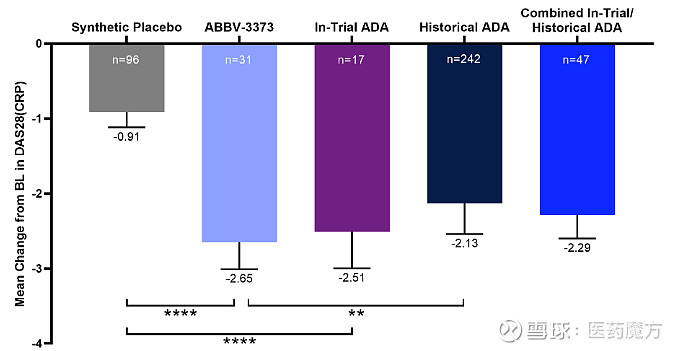
ABBV-3373疗效数据(参考来源[3])
ABBV-3373的疗效与安全性数据让艾伯维看到了iADC的可能,于是其在ABBV-3373的结构基础上进行了连接子技术的优化,得到了更有治疗潜力的ABBV-154。艾伯维也在2021年同时启动了ABBV-154治疗RA的II期M20-466研究、治疗风湿性多肌痛(PMR)的II期M20-370研究以及治疗克罗恩病(CD)的II期M20-371研究。
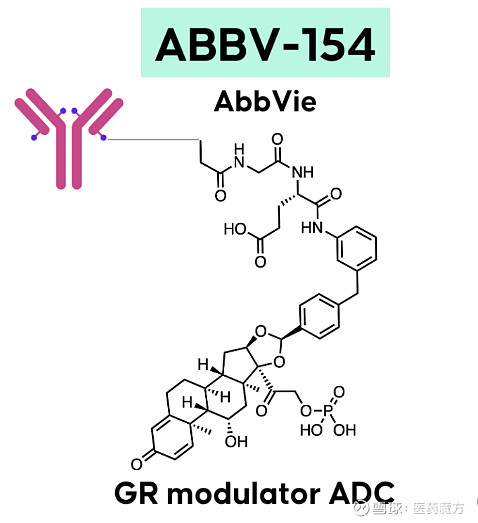
ABBV-154结构(参考来源[4])
然而,在创新药研发领域,好的idea到创新技术的真正落地必然是充满了各种不确定性,iADC也难逃这样的命运 。2022Q3~2023Q1期间,艾伯维先后终止了ABBV-154用于治疗RA、PMR、CD的临床研究。艾伯维首席科学官Thomas Hudson表示,虽然ABBV-154显示出来一定的疗效,但也观察到生物标志物的一些变化与较高剂量的系统性糖皮质激素暴露,收益风险比不足以将ABBV-154与其它可用疗法区分开来。
但艾伯维并没有放弃以GRM作为载荷的ADC研发。ABBV-319是一款靶向CD19的ADC药物,其与ABBV-154选用了相同的linker-payload,DAR值也为4。目前ABBV-319已进入了治疗血液瘤的I期临床(NCT05512390)。
目前来看,我们尚且不能因为ABBV-154的失败就为iADC下定义,CAR-T、TIL等新技术的最初发展也非一帆风顺。作为自免ADC的开拓者,艾伯维敢于尝试的勇气和魄力就已足够令人倾佩。
总结
除前文提到的ADC项目外,艾伯维管线中还包括了两款靶向SEZ6的ADC ABBV-011和ABBV-706,瞄准的适应症领域正是Rova-T折戟的SCLC。与此同时,从收购Stemcentrx囊获的靶向PTK7的ABBV-647、靶向LRRC15的ABBV-085等多款ADC项目也已进入临床I期,未来还需要更多的临床数据来验证靶点的可行性。
毫无疑问,未来ADC的市场竞争只会更加激烈。对于未能占领先机的艾伯维来说,要想在众多ADC玩家中脱颖而出,就必须站在前人的肩膀上,在靶点、抗体、毒素、偶联方式等方面打造出具有差异化优势的产品,才有可能抓住弯道超车的机会。
参考文献
[1] 网页链接
[2] doi: 10.1158/1078-0432.CCR-16-1568.
[3] doi: 10.1002/art.42415.
[4] Merck's Oral PCSK9 Inhibitor and Nurix's BTK Degrader Among ACS First Disclosures - Drug Hunter
[5] 煮酒论药: 后疫情时代-站在十字路口的MNC Quo Vadis (3) 艾伯维,王的最后盛宴