7 月 11 日,ADC赛道领军企业ADC Therapeutics(简称ADCT)宣布自愿暂停II期LOTIS-9研究(NCT05144009)的新患者入组。LOTIS-9研究是在既往未接受过治疗且健康状况不佳/虚弱的弥漫性大B 细胞淋巴瘤(DLBCL)患者中评价Zynlonta®(loncastuximab tesirine-lpyl,简称Lonca)与利妥昔单抗联合用药方案(Lonca-R)的疗效和安全性,已经入组了40 名患者。在审核汇总数据并咨询了数据监察委员会(DMC)后,ADCT自愿采取了上述行动。
暂停入组新患者的原因主要是在LOTIS-9研究中观察到一些与呼吸系统有关的治疗中出现的不良事件 (TEAE) ,包括 7 例致死性和5例 3 -4 级TEAE。不过研究者评估认为上述12 例事件中的 11 例(包括 7 例致死事件中的 6 例)与研究药物(Lonca-R)无关或可能无关。目前,5例 3 -4 级事件中的4例已缓解,患者已按照方案完成研究药物治疗。这些事件的起因仍在进一步调查中,但出于患者安全的考虑,ADCT公司仍决定暂缓该研究的新患者入组。
ADCT首席执行官Ameet Mallik表示:“参与我们临床试验的每一位患者的安全是我们的首要任务。考虑到LOTIS-9研究中出现的呼吸系统相关事件的总数,我们自愿暂停入组,以便对数据集进行彻底审查。该研究包括一个非常难以治疗的患者群体,治疗选择有限,我们将在适当时提供下一步行动的最新情况。”
进一步分析来看,LOTIS-9研究中发生致死性事件的患者均伴有一种或多种明显的潜在活动性呼吸系统和/或心脏合并症,包括严重的慢性阻塞性肺病、肺水肿、慢性支气管扩张、特发性肺纤维化和近期的COVID-19感染,且所有患者年龄均≥80岁(平均年龄为82.7岁),从研究药物最后一次给药到死亡的平均时间为 51 天(19 - 86 天),属于基础健康状态相对较差的患者。而在其他Lonca单药方案研究LOTIS-1、LOTIS-2、中国桥接关键临床试验OL-ADCT-402-001研究以及Lonca的上市后监测中,均未观察到类似的呼吸系统安全性信号。
尽管LOTIS-9研究暂停了新患者入组,但考虑到Lonca-R联合方案在LOTIS-9研究中展示出令人鼓舞的初步疗效(ORR达94.1%,CR达58.8%),以及综合疗效获益与安全性风险的平衡,ADCT决定已入组患者将继续接受Lonca-R联合方案的治疗,同时考虑修改LOTIS-9的入排标准,以进一步降低发生肺相关不良事件的风险。需要指出的是,同样是以Lonca-R联合方案作为研究对象,Lonca的另一项全球(含中国)确证性III期——LOTIS-5研究(ADCT-402-311研究)正在进行中。根据LOTIS-5研究的入排标准,并不会纳入LOTIS-9研究中发生3-5级TEAE那样基础条件的患者,也未见LOTIS-5研究报道类似安全性事件,其安全性结果值得进一步观察。
Loncastuximab tesirine是当前全球唯一一款获批的CD19靶向ADC药物,主要依托ADCT公司先进的技术平台将活性最强的细胞毒素吡咯并苯二氮杂䓬二聚体(PBD)递送到表达CD19的肿瘤细胞。PBD进入肿瘤后通过与DNA小沟结合,形成强效的细胞毒性DNA链间交联,导致DNA复制停滞,阻断细胞周期从而导致肿瘤细胞死。在早期临床试验中,ADCT找到了Lonca临床疗效与安全风险之间的最佳平衡点,确定了精准科学的给药方案。
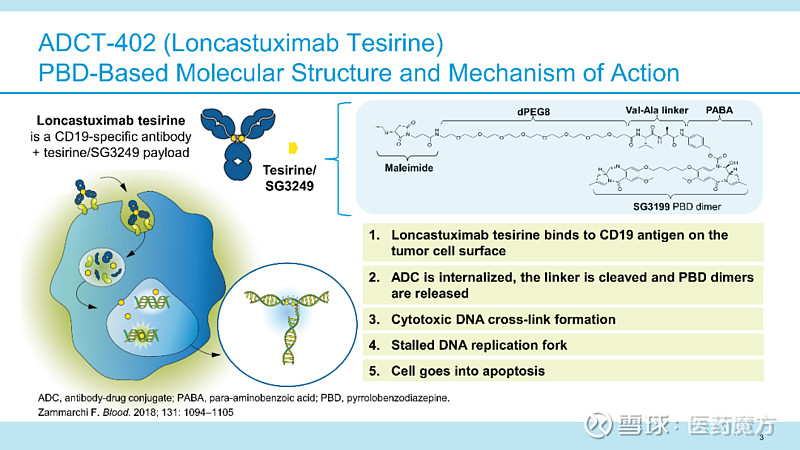
Lonca结构与作用机制(来源:ADC Therapeutics)
2021年4月,Lonca凭借LOTIS-2的研究结果获得FDA加速批准上市,用于治疗至少接受过2线及以上系统治疗的复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者,包括非特定类型的DLBCL、惰性淋巴瘤转化的DLBCL和高级别B细胞淋巴瘤。
受到Lonca单药出色疗效和良好安全性信号的鼓舞,ADCT和瓴路药业在全球范围内合作开展了另一项针对R/R DLBCL患者(二线及以上治疗)的确证性III期临床试验——LOTIS-5研究(ADCT-402-311研究),旨在评估Lonca联合利妥昔单抗(Lonca-R)对比利妥昔单抗联合吉西他滨及奥沙利铂(R-GemOx)的有效性和安全性。在2022年第10届美国血液肿瘤学学会年会(SOHO)上,LOTIS-5安全导入期的详细安全性与疗效数据结果首次披露。数据显示20例患者中有15例患者经过Lonca+R治疗后达到疾病缓解(ORR为75%),其中有8例患者达到完全缓解(CRR为40%),显示出Lonca-R联合方案有望成为 R/R DLBCL二线标准治疗的巨大潜力。
2023年4月,瓴路药业宣布,针对中国R/R DLBCL 患者的注册性II期临床试验OL-ADCT-402-001达到总缓解率(ORR)的主要研究终点,其有效性与安全性数据与全球关键临床试验LOTIS-2研究的结果一致。基于这项研究结果,中国国家药监局药品审评中心(CDE)官网于6月8日公示,瓴路药业申报的注射用loncastuximab tesirine拟纳入优先审评,拟用于治疗二线或多线系统治疗后复发或难治性大B细胞淋巴瘤成年患者。6月底,瓴路药业即向NMPA提交了该产品在国内的上市许可申请。
目前来看,LOTIS-9研究中的肺部不良事件仅局限于该研究特殊的DLBCL患者人群,并没有证据表明这类安全性风险与Lonca单药或者Lonca-R联合方案相关。Lonca在中国的新药上市申请以及正在开展的LOTIS-5研究进程并未受到影响。
近日,由CSCO淋巴瘤专家委员会、CSCO白血病专家委员会编纂的全国首部《抗体药物偶联物治疗血液肿瘤临床应用专家共识》将Lonca作为首批血液肿瘤创新治疗药物进行收录。CSCO理事会常务理事、中国抗淋巴瘤联盟主任委员朱军教授指出:“Lonca单药方案是一种可及性更广、耐受性更好、使用更便捷的治疗选择。期待Lonca能够顺利获批上市,从而为中国患者带来新的希望,新的选择。”中国临床肿瘤学会(CSCO)监事会监事长、CSCO抗白血病联盟主席马军教授也表示:“Lonca-R联合方案具有缓解率高、起效快、耐受性好、用药便捷、可应用于门诊的优势,应用于二线治疗、乃至一线治疗的潜力巨大。”