1月29日,先声药业的新冠口服药先诺欣(先诺特韦/利托那韦)获国家药监局附条件批准上市,成为第一款由国内药企自主研发且获批上市的3CL蛋白酶抑制剂。在此之前,同靶点药物仅辉瑞开发的Paxlovid(奈玛特韦/利托那韦)在国内获批上市,先诺欣的获批改变了Paxlovid一家独占的局面,同时也有可能改变全面开放后备受新冠感染困扰的广大民众一药难求的困境。
3CL是在冠状病毒中发现的主要蛋白酶,在病毒复制过程中不可或缺。抑制这一位点的蛋白水解将使新冠病毒复制所需要的蛋白无法产生,进而抑制病毒复制,相当于扼住了新冠病毒变异株的“咽喉”,从源头上让病毒失去了感染正常细胞和扩散的能力,是真正意义上以病毒为目标的靶向治疗。3CL切割位点高度保守,不易受病毒突变影响。同时,因为人体内没有3CL同源蛋白,所以人体服用3CL口服小分子药物后,不会对人体产生遗传毒性,副作用风险较小。
辉瑞是3CL赛道的领跑玩家。2021年12月22日,Paxlovid凭借II/III期EPIC-HR研究的积极结果获FDA紧急使用授权,治疗轻中度COVID-19感染,适用于SARS-CoV-2病毒检测阳性且具有进展为重症COVID-19高风险的12岁及以上(体重≥40kg)人群,成为全球首款上市的3CL口服小分子药物。随后,Paxlovid于2022年2月10日在中国获批上市。同年4月,Paxlovid被世界卫生组织推荐为轻症治疗的唯一方案。
从国内视角来看,先声药业也是3CL赛道的领跑玩家。2022年3月28日,先诺特韦(SIM0417)首次获批临床,成为首款进入临床阶段的3CL蛋白酶抑制剂。随后,仅费时10个月先诺特韦即完成从临床开发到上市的整个流程。
适用人群更广,清除病毒能力更优
同为小分子新冠口服药物,先诺欣相比Paxlovid、莫诺拉韦有什么特别之处相信也是大家比较关心的。
首先是适应症方面,Paxlovid的适用范围为无需住院但有进展为重症风险(即高风险)的18岁以上轻中度新冠感染人群,作用是降低这些患者的住院或死亡风险;莫诺拉韦的适用范围为无需住院但有进展为重症风险(即高风险)的轻中度新冠感染成人患者。这意味着Paxlovid和莫诺拉韦均不适用于无症状和非高风险人群。此外,Paxlovid在美国还有另一个限制条件——仅限于体重超过40kg的患者使用。而先诺欣的适用范围为轻中度新冠感染成人患者,并未规定体重和其它限制条件。在先声已披露的临床试验中,也未限制入组人群为高风险患者。
在降低病毒载量方面,Paxlovid、莫诺拉韦和先诺欣亦有差异。
《柳叶刀》杂志发表的文章显示,随着一代病例病毒载量的增加,其接触者发病的比例也随之增加。当一代病例病毒载量<1×107拷贝数/毫升时,约38%接触者出现临床症状,而当一代病例的病毒载量≥1×1010拷贝数/毫升时,接触者中出现临床症状的比例增加至66%。所以,有效抑制人体内的病毒载量,就能减少新冠病毒的传染性,更能极大降低可能引发的危重症和死亡比例。
EPIC-HR研究分析了1574例患者在用药后第5天的鼻拭子样本,数据显示Paxlovid组患者在出现症状的3天内用药时,其鼻拭子病毒载量的校正平均值相比安慰剂组降低了0.868±0.105 log10拷贝数/mL(P<0.001);患者在出现症状的5天内用药时,其鼻拭子病毒载量的校正平均值相比安慰剂组降低了0.695±0.085 log10拷贝数/mL(P<0.001)。
MOVe-OUT研究分析了964例患者在用药后第5天的鼻拭子和咽拭子样本,数据显示莫诺拉韦组患者样本中的病毒载量的平均值变化相比安慰剂组降低了0.33 log10拷贝/mL(未披露P值)。
据先声药业公告,先诺欣的II/III期研究分析了1208例患者在用药后第5天的咽拭子样本。数据显示,先诺欣组患者病毒载量呈现快速、大幅的下降,相比安慰剂组最大降幅超96%。由此可见,先诺欣降低轻中度新冠感染患者病毒载量的能力十分优异。此外,横向对比其它靶点的新冠药物,先诺欣同样具有疗效优势。
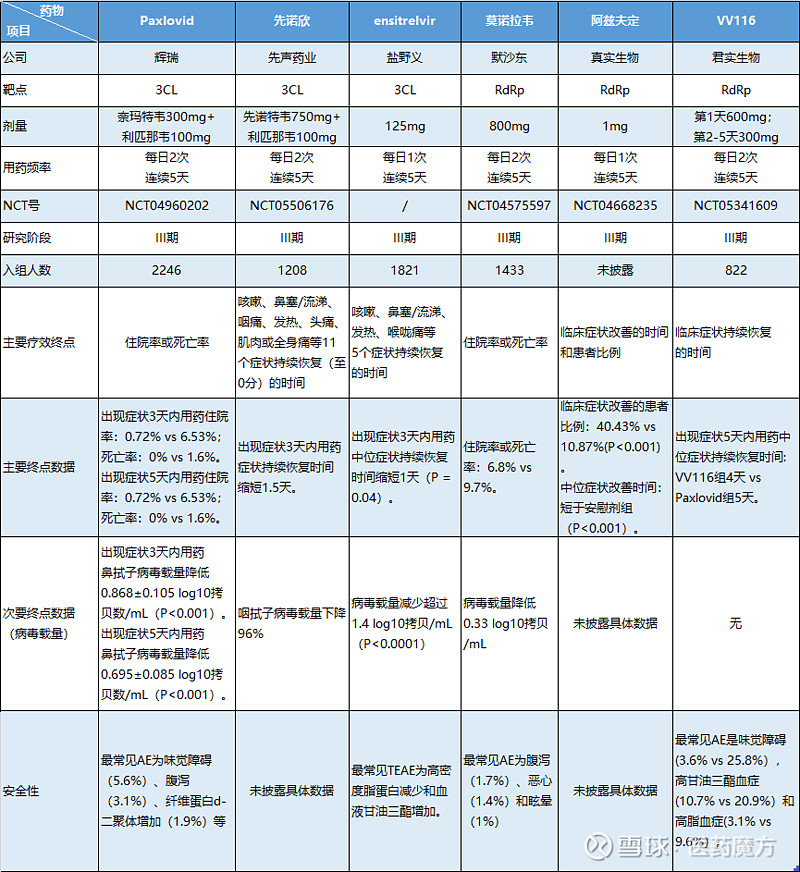
先诺欣还有一个特别之处——完成了第一个达成以“咳嗽、鼻塞流涕、咽痛、发热、头痛、肌肉或全身痛等11个症状持续恢复(至0分)”为主要终点的III期注册临床研究。该研究对“持续恢复”的定义为患者的11种目标新冠症状评分均为0分且持续2天,也就是说,不同于部分新冠药物以症状改善为临床终点,先诺欣是真正将新冠症状消除作为终点设计。
数据显示,在接受5天疗程治疗后,先诺欣组患者的11种症状持续恢复时间较安慰剂组缩短1.5天,其中重症高风险亚组人群显著缩短约2.4天;核酸转阴时间缩短2.2天。在安全性方面,未观察到先诺欣引起诱变作用的安全性问题,治疗组整体安全性良好。
辉瑞也曾启动了一项III期研究(EPIC-SR)以评估Paxlovid持续缓解患者新冠症状的能力。该研究共纳入了1153例无重症风险的成年患者,主要终点为所有新冠症状连续4天持续缓解的时间。然而,该研究未能达到主要终点,辉瑞也因此提前终止研究。而盐野义虽然也评估了Xocova(ensitrelvir)的消除新冠症状能力,但仅限于咳嗽、鼻塞、流涕、发热、喉咙痛这5项症状,且其病程缩短时间与安慰剂组比仅为1天。
定价低于Paxlovid,可被纳入临时医保目录
2023年1月6日,国家卫生健康委办公厅、国家中医药局综合司联合印发《新型冠状病毒感染防控方案(第十版)》,其中第十一章节“治疗”的第(二)条“抗病毒治疗”第7条,明确写明包含“国家药品监督管理局批准的其他抗新冠病毒药物”。
2023年1月7日,国家医保局发布《国家医保局 财政部 国家卫生健康委 国家疾控局关于实施“乙类乙管”后优化新型冠状病毒感染患者治疗费用医疗保障相关政策的通知》,其中第二条“执行临时医保药品目录,满足患者用药需求”中写明“新型冠状病毒感染诊疗方案中新型冠状病毒治疗药品延续医保临时支付政策,先行执行至2023年3月31日。”
先声药业表示,基于以上两条政策文件,先诺欣上市后将自动进入第十版《新型冠状病毒感染防控方案》,并纳入临时医保药品目录,购买者仅需支付医保报销后的个人自付部分。
此外,先声药业表示,先诺欣获批上市后将立即投产,并将按照国家相关部门统筹指导安排,在产能初期优先保供我国疫情严重的地区,并视国内疫情的进展情况,做好动态增产保供的准备。
与目前国内已上市的其他新冠药类似,先诺欣进入流通环节后,将在医院、线上互联网医院进行全面销售,结合先声药业的成本优势与中国国情,先诺欣定价将大幅低于同靶点药物辉瑞Paxlovid。
参考资料
[1]Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19
[2]Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients
[3]先声药业公告
[4]网页链接
[5]网页链接
[6]VV116 versus Nirmatrelvir–Ritonavir for Oral Treatment of Covid-19
[7]网页链接