2023年1月27日,FDA批准elacestrant(Orserdu)用于既往接受过至少一线内分泌治疗后疾病进展的ER+、HER2-、ESR1突变的绝经后女性或成年男性晚期或转移性乳腺癌患者。

FDA还批准了Guardant360 CDx检测作为辅助诊断设备,用于识别接受elacestrant治疗的乳腺癌患者。
EMERALD 研究(NCT03778931)是一项多中心、随机、开放标签、阳性对照III期临床试验,共纳入了478例ER+、HER2-晚期或转移性绝经后女性和男性患者,其中228例患者有ESR1突变。试验要求患者在既往接受过一线或二线内分泌治疗(包含CDK4/6抑制剂)后出现疾病进展。符合条件的患者最多接受过一线化疗。患者被随机分组(1∶1),分别接受elacestrant 345 mg口服,每日1次(n=239)或研究者选择的内分泌治疗(n=239),包括氟维司群(n=166)或芳香化酶抑制剂(n=73)。试验根据ESR1突变状态(检出vs.未检出)、既往接受氟维司群治疗(是vs.否)和内脏转移(是vs.否)对进行分层。ESR1突变状态通过使用Guardant360 CDx检测法的ctDNA确定,并且仅限于配体结合域的ESR1错义突变。
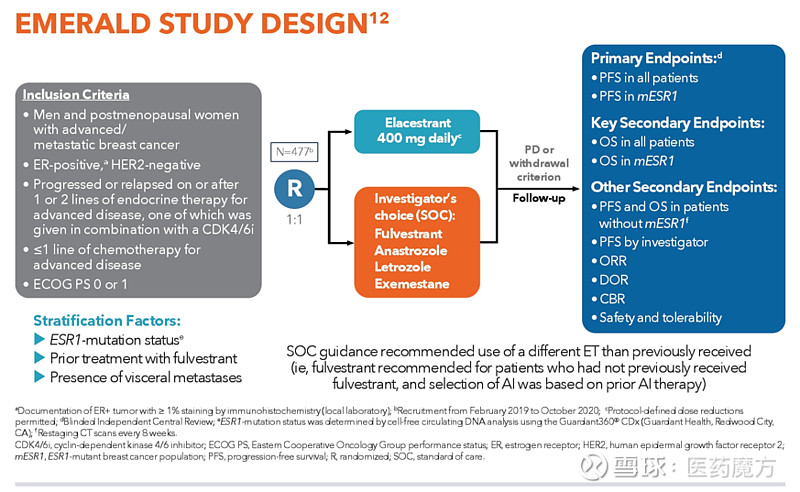
主要疗效终点是无进展生存期(PFS)。在意向性治疗(ITT)人群和ESR1突变患者亚组中观察到PFS有显著统计学差异。
在228例(48%)有ESR1突变的患者中,elacestrant组和氟维司群或芳香化酶抑制剂组的中位PFS分别为3.8个月和1.9个月(HR=0.55 ,95% CI: 0.39-0.77,双侧p值=0.0005)。
对250例(52%)无ESR1突变患者的PFS进行的探索性分析显示,HR为0.86 (95% CI: 0.63-1.19),表明ITT人群的改善主要归因于ESR1突变人群的结果。
最常见的不良事件(≥10%)包括实验室指标异常,包括肌肉骨骼疼痛、恶心、胆固醇升高、AST升高、甘油三酯升高、疲劳、血红蛋白降低、呕吐、ALT升高、钠降低、肌酐升高、食欲下降、腹泻、头痛、便秘、腹痛、潮热和消化不良。
推荐的elacestrant剂量为每日1次,随食物口服345 mg,直至疾病进展或出现不可接受的毒性。
文章来源:FDA approves elacestrant for ER-positive, HER2-negative, ESR1-mutated advanced or metastatic breast cancer | FDA