6月7日,赛诺菲和再生元联合宣布,美国FDA已批准度普利尤单抗(dupilumab,商品名:Dupixent,达必妥 )用于无法通过外用疗法治疗或得到控制的6个月到5岁中重度特应性皮炎患者。这是首个也是唯一一个获FDA批准治疗从婴儿到成人中重度特应性皮炎的药物。

该批准基于一项随机双盲、安慰剂对照的III期临床数据,旨在评估度普利尤单抗在6个月至5岁中重度特应性皮炎患者中的疗效和安全性。试验共纳入162名儿科患者,随机接受度普利尤单抗+低强度TCS(治疗组)、单用TCS(安慰剂组)治疗。
结果显示,在第16周时,试验达到主要终点和所有次要终点。
治疗组28%患者皮肤症状完全或接近完全清除,对照组为4%。
治疗组53%患者达到疾病严重程度与基线相比改善75%以上,对照组为11%。
治疗组48%患者获得具有临床意义的瘙痒减弱,对照组为9%。
安全性方面,在6个月至5岁患儿中观察到的结果与6岁以上患者一致。该试验分别有5%和2%报告了手足口病和皮肤乳头状瘤,这些病例均未导致治疗中断。
度普利尤单抗是由赛诺菲和再生元联合开发的一款抗IL-4/IL-13单抗,能选择性抑制关键信号通路IL-4和IL-13,阻断Th2型炎症通路,降低Th2型炎症的病理性反应,从而治疗Th2型炎症相关疾病。
它是美国首个上市的特应性皮炎生物制剂,2017年3月首次获批治疗成人中重度特应性皮炎,2019年3月和2020年5月扩展人群,用于治疗12-17岁青少年以及6-11岁儿童中重度特应性皮炎。2020年6月,该产品进入中国市场,已获批用于6岁以上中重度特应性皮炎患者。
目前,度普利尤单抗已有多项适应症在美国、欧盟等地上市,分别是哮喘、特应性皮炎、伴有鼻息肉的慢性鼻窦炎(CRSwNP)和嗜酸性食管炎。
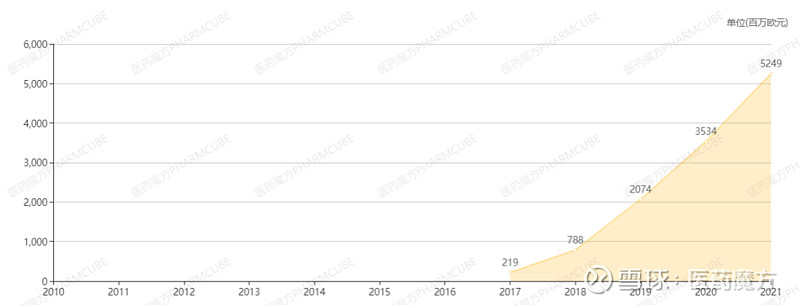
自上市以来,度普利尤单抗市场表现良好,2021年销售额高达52.49亿欧元,同比增长52.7%。这得益于成人、青少年、6-11岁儿童特应性皮炎患者的需求持续释放,以及在哮喘、慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)适应症上的标签扩大和患者渗透。
度普利尤单抗是美国第一款横跨皮肤科、变态反应、呼吸科科室用药的生物制剂,赛诺菲计划将其打造为年销售额过100亿欧元的重磅炸弹。