日前,《柳叶刀》预印本发布了mRNA新冠疫苗BNT162b2(复必泰)中国II期临床试验的主要研究数据。结果显示,间隔21天接种2剂复必泰后,健康或患有稳定基础疾病的中国成年人产生了强烈的免疫应答,并且耐受性、安全性良好。这是首个披露针对中国人群II期临床数据的mRNA新冠疫苗。

该试验是一项随机双盲、安慰剂对照的II期临床研究,旨在评估BNT162b2在中国成人中的疗效和安全性。2020年12月5日至2021年1月9日期间,试验共招募960名受试者,分为2个年龄组(18-55岁、56-85岁)。然后受试者按3:1的比例随机接受2剂30μg BNT162b2或安慰剂注射,2剂间隔时间为21天。
主要目的是描述中国健康受试者在BNT162b2预防性疫苗第2剂接种1个月后的体液免疫应答。次要目的包括:1)观察直至研究结束,中国健康受试者接种BNT162b2的体液免疫应答。2)在每次接种后7天和14天内,观察间隔21天给予BNT162b2或安慰剂的安全性和耐受性特征。3)观察直至研究结束,BNT162b2在中国健康受试者中接种的安全性。
意向治疗(ITT)人群中959名受试者接受了至少1剂BNT162b2(n=720)或安慰剂(n=239)注射。这些受试者,几乎都接受了2剂注射。本次分析的数据截止时间为2021年2月7日。
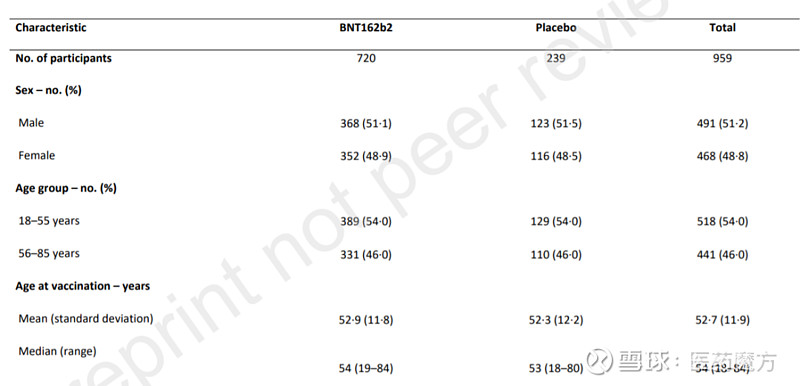
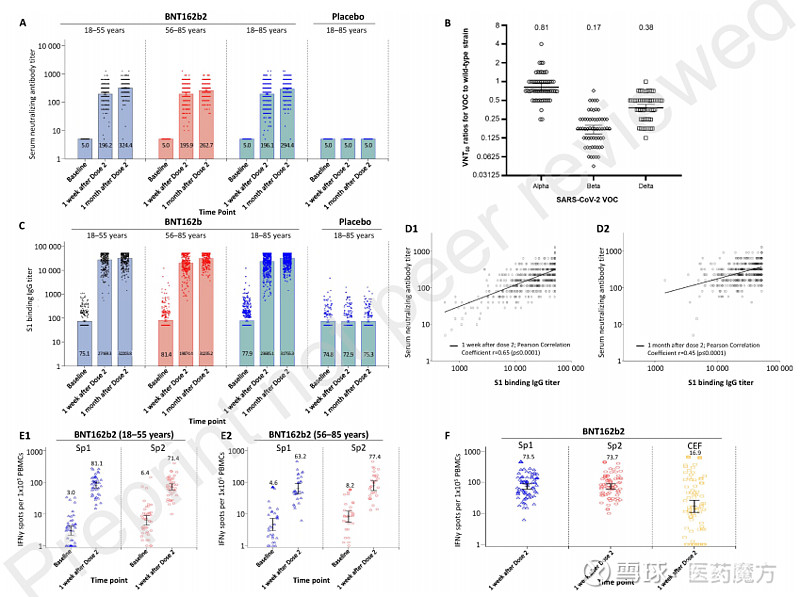
试验结果如下图所示,以30μg、间隔21天接种2剂BNT162b2的方案给药后,受试者产生了强烈的免疫应答,并且在健康或患有稳定的既往疾病的中国成年人中通常具有良好的耐受性。
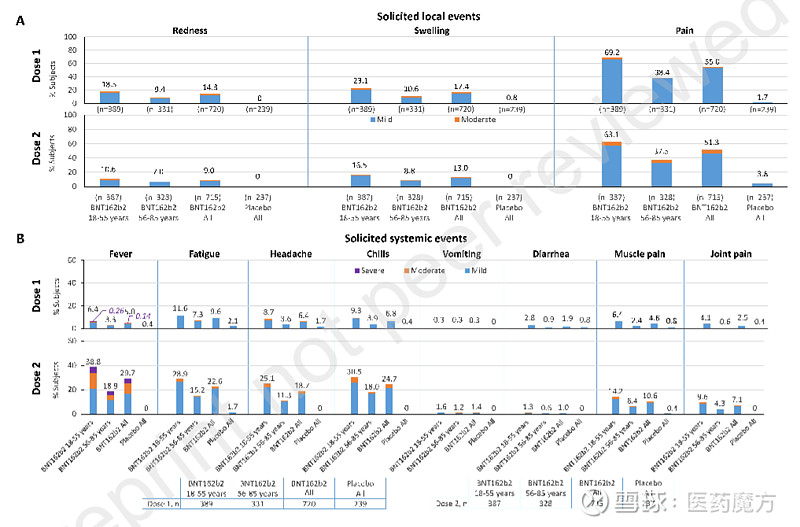
在安全性方面,每次给药后7天内,BNT162b2组受试者出现轻中度局部和全身性事件更频繁,不过大多数都是短暂性事件。其中最常见的局部事件是注射部位疼痛,最常见的全身性事件是发热。
此外,近日中国商标网官网显示,由复星医药申请的复必泰商标已获核准注册,专利权期限为2022年05月28日至2032年05月27日。
BNT162b2由德国企业BioNTech公司基于其专有的mRNA技术平台开发的一款mRNA疫苗。2020年3月13日,复星医药与BioNTech达成许可协议,以8500万美元的许可费和约定的销售提成获得在大中华区开发和商业化的权利。