
11月30日,ImmunoGen 宣布评估mirvetuximab soravtansine单药治疗接受过贝伐珠单抗的叶酸受体α(FRα)高表达铂耐药卵巢癌患者的SORAYA研究获得阳性一线结果。ImmunoGen表示计划2022年第一季度向FDA提交上市申请。
SORAYA研究是一项单臂试验,纳入的106例卵巢癌患者均为FRα高表达,既往接受过最多3种疗法并且至少一种是贝伐珠单抗,主要终点是研究者评估的经确认的ORR,次要终点是DOR。
截至2021年11月16日,中位随访时间8.1个月,研究者评估的ORR未32.4%,其中包括5例完全缓解。BICR评估的ORR为31.6%,其中5例完全缓解。药物疗效与既往是否接受过PARP抑制剂或者接受过的治疗药物种类无关。DOR为5.9个月。
mirvetuximab soravtansine耐受性良好,安全性数据与既往700多例患者的研究数据一致。治疗相关不良事件导致的给药中断为19%,给药延迟为32%,终止治疗为7%。最常见治疗相关不良事件包括视力模糊(41%,3级以上6%),角膜病(35%,3级以上9%)和恶心(29%,3级以上0%)。
mirvetuximab soravtansine是一种包含FRα抗体、可裂解连接子和美登木素生物碱DM4(一种强效的微管蛋白靶向剂)的抗体偶联药物,也是全球开发进度最快的针对FRα阳性卵巢癌的ADC在研药物,属于First-in-class产品。
叶酸受体 α(FRα)在实体瘤如卵巢癌,肺癌和乳腺癌中高表达,在正常细胞中表达很低。mirvetuximab soravtansine通过与肿瘤细胞膜表面的FRα结合,通过内吞效应进入肿瘤细胞,在肿瘤细胞内酶的作用下,释放抗微管药物DM4,通过抑制微管蛋白聚合和微管聚集,导致细胞周期中止和细胞凋亡。
ImmunoGen在2016-2018 年间开展的一项代号为 FORWARD I 的III期临床研究评估了MIRV治疗FRα阳性、铂耐药卵巢癌患者疗效,招募的受试者为表达中等或高水平FRα且既往接受过至多3种治疗方案的铂耐药卵巢癌患者。
2019年3月1日,ImmunoGen宣布 FORWARD I 未能达到主要终点。虽然MIRV组患者的客观缓解率(ORR)为22%,化疗组为12%(P=0.015),但是作为主要临床终点的 PFS(HR:0.981, P=0.897),和总生存期OS(HR:0.815, P=0.248),均未表现出统计学意义上的差异。
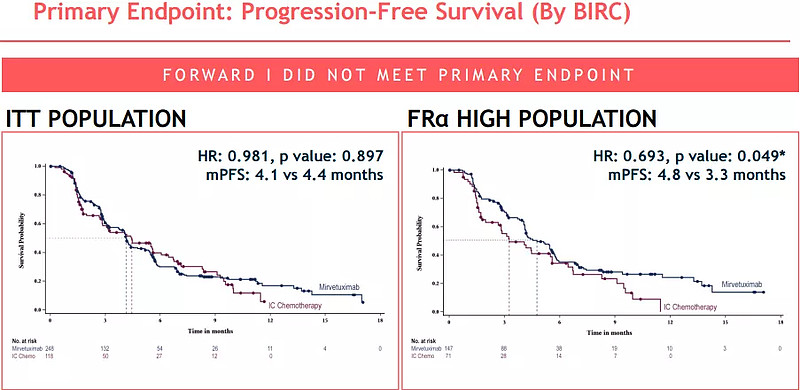
初次分析结果显示该研究未达到PFS主要终点
ImmunoGen随即对该临床试验数据重新进行了分析,发现在FRα高表达的亚组患者中(占比60%),与化疗相比,MIRV组患者呈现出更高的ORR(24% vs 10%, P=0.014)),PFS(4.8个月 vs 3.3个月,HR:0.693, P=0.049)和OS(HR:0.618,P=0.033)。
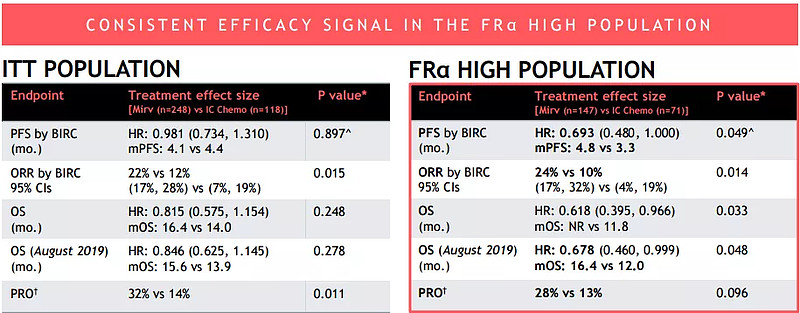
FRα高表达亚组PFS、ORR、OS较化疗显示出差异
基于对 FORWARD I 临床试验的总结,ImmunoGen 在与FDA沟通后,在 2019年底和2020年中分别启动了2项代号为MIRASOL和SORAYA的关键性III期临床研究。
除了此次公布一线结果的SORAYA研究,MIRASOL研究是计划入组430例采用PS2+评分法确认为表达高水平FRα且既往接受过至多3种治疗方案的铂耐药卵巢癌患者,患者将以1:1的比例随机接受 MIRV或研究者选择的化疗方案。主要终点为 PFS,关键次要终点包括 ORR、OS等。
此外,ImmunoGen还开展一项代号为 FORWARD II 的Ib/II期临床研究,用以评估MIRV与贝伐珠单抗联用、MIRV与卡铂联用、MIRV与阿霉素脂质体(PLD)联用、MIRV与卡铂+贝伐单抗联用以及MIRV与帕博利珠单抗等5种联用方案,治疗成人FRα阳性卵巢癌、原发性腹膜或输卵管肿瘤患者的安全性、耐受性和药代动力学特性(PK)。
2020年5月ASCO会议上,ImmunoGen报道了FORWARD II研究中MIRV联合贝伐珠单抗的临床试验数据,在60例既往接受过中位数2次治疗(1-4次)的受试者中,28例受试者观察到客观缓解,ORR为47%。其中肿瘤FRα高表达(n=33)亚组患者的ORR为64%,铂耐药和铂敏感亚组患者ORR均至少为50%。
2020年9月ESMO会议上,ImmunoGen公布了FORWARD II研究中三药联合临床试验的最终数据。41名铂敏感的晚期卵巢癌受试者(既往接受过最多不超过2次治疗)接受MIRV、贝伐珠单抗及卡铂三药联合治疗后的ORR为83%,DOR为10.9个月,PFS为12.8个月。
2020年10月20日,华东医药与 ImmunoGen达成协议,获得了在大中华区(含中国大陆,香港、澳门和台湾地区)独家临床开发及商业化IMGN853的权益,支付4000万美元首付款和最高可达2.65亿美元的里程碑付款,以及约定比例的销售额提成费。
今年3月30日,华东医药在国内提交的Mirvetuximab soravtansine临床试验申请已获得NMPA默认许可,拟开展针对叶酸受体α(FRα)高表达的铂类耐药的晚期高级别上皮性卵巢癌、原发性腹膜癌或输卵管癌患者的临床研究。