5月14日,Apellis宣布,美国FDA已批准Empaveli (pegcetacoplan)上市,用于治疗未经治疗的成人阵发性睡眠性血红蛋白尿症(PNH)和既往接受过补体C5抑制剂Soliris (依库珠单抗)和Ultomiris (ravulizumab)治疗的PNH患者。Empaveli是FDA批准的首个治疗PNH的靶向补体C3疗法。

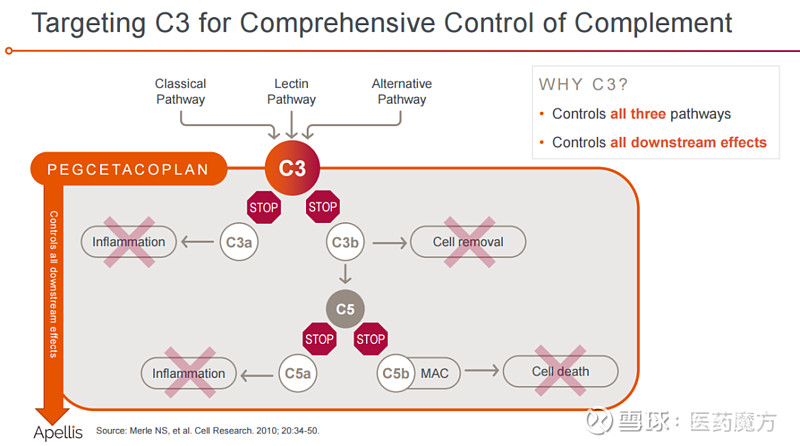
Pegcetacoplan是一种靶向补体C3疗法,旨在调节补体级联的过度激活,补体级联是人体免疫系统的一部分,过度激活可导致多种严重疾病的发生和进展。pegcetacoplan是一种合成的环肽,与聚乙二醇聚合物偶联,特异性结合于C3和C3b。
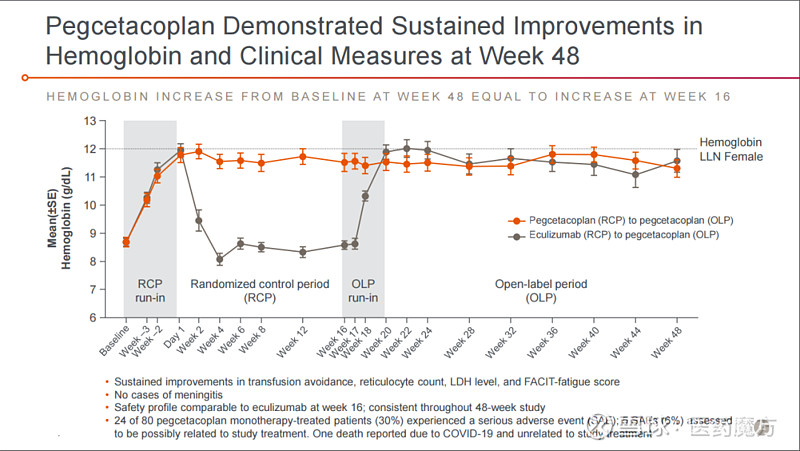
Pegcetacoplan的批准是基于代号为PEGASUS的III期临床研究积极结果,患者接受治疗16周时,pegcetacoplan组血红蛋白水平较基线的变化值优效于活性对照组依库珠单抗,调整后的血红蛋白平均增加3.84 g/dL (p≤0.0001)。此外,pegcetacoplan组患者在避免输血终点方面非劣效于依库珠单抗组。接受pegcetacoplan治疗的患者中有85%在16周内没有输血,而依库珠单抗组患者这一比例仅为15%。

并且接受pegcetacoplan初始治疗或经由依库珠单抗转换至pegcetacoplan治疗患者的疗效在第48周时仍得以维持。
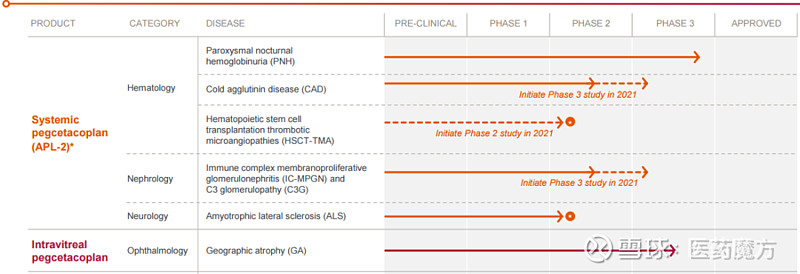
Pegcetacoplan还被开发用于治疗地图样萎缩、冷凝集素病、C3肾小球病、肌萎缩侧索硬化症等疾病。
依库珠单抗是Alexion公司开发的针对补体C5 的重组人源化单克隆抗体,于2007年首次获准上市,目前已获批4种罕见病适应症:PNH、非典型溶血尿毒症综合征(aHUS)、抗AchR抗体阳性全身性重症肌无力(gMG)、抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)。依库珠单抗于2018年9月4日获NMPA批准上市,用于治疗成人和儿童PNH和非典型溶aHUS。依库珠单抗也是全球最畅销的孤儿药之一,2020年销售额高达40.64亿美元。
阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的、慢性、危及生命的血液疾病,由获得性突变引起,导致补体激活失控,并通过血管内和血管外溶血破坏红细胞。十多年来,C5抑制剂是治疗PNH的唯一选择,许多患者仍在遭受持续的低血红蛋白困扰,需经常忍受衰弱性疲劳和频繁输血。一项对使用C5抑制剂治疗的患者进行的回顾性和横断面研究显示,至少72%的患者血红蛋白持续降低,至少36%的患者每年需要一次或多次输血。
