
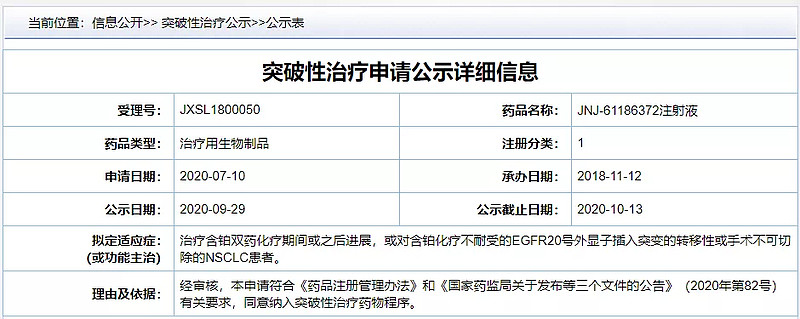
9月29日,强生JNJ-61186372注射液(amivantamab )被国家药品监督管理局药品审评中心(CDE)纳入“拟突破性治疗药物品种”公示,用于治疗含铂双药化疗期间或之后进展或对含铂化疗不耐受的EGFR20号外显子插入突变的转移性或手术不可切除的NSCLC患者。
EGFR突变是非小细胞肺癌患者常见的基因突变,大约占到10%~15%,在亚洲人群中,这一数值大约为40%~50%。EGFR常见的突变位点是外显子19和21,占大约90%,称为经典型突变,其余大约10%为外显子18和外显子20突变。EGFR 外显子20突变中除了经典的T790M耐药突变可以使用奥希替尼治疗,还有外显子20插入突变也被认为是一种耐药突变。EGFR外显子20插入突变大约占到所有EGFR突变非小细胞肺癌患者的9%,目前还没有获批的靶向药,预后很差。
Amivantamab是一种靶向EGFR和MET的双特异性抗体,不但能够阻断配体与EGFR和MET的结合,促进受体降解,还可触发抗体依赖性细胞毒性,正在进行针对晚期难治性NSCLC患者的首次人体研究。今年3月,美国FDA也授予Amivantamab突破性疗法认定,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌患者。

FDA授予Amivantamab突破性疗法认定是基于一项开放标签,多中心、I期研究的数据。该研究评估了JNJ-6372单药和联合lazertinibi(第三代EGFR TKI)治疗成人晚期NSCLC的安全性、药代动力学和初步疗效。ASCO2019大会公布的结果显示,截至2019年1月17日,结果显示,在88位可评估反应的患者中,有28%达到了PR。47例经三代EGFR抑制剂治疗后耐药的患者(1例C797S突变,1例cMet扩增和5例没有可识别的EGFR / cMet依赖性耐药)中有10位达到部分缓解。20例存在外显子20插入的患者中6例达到部分缓解。
Amivantamab联合lazertinibi目前在中国境内已经许可开展了多项临床研究,包括:
治疗EGFR 19号外显子缺失或L858R激活突变,且在使用第一代(例如厄洛替尼、吉非替尼等)或第二代(例如阿法替尼、达克替尼等)TKI 进行一线治疗或在使用第三代TKI(例如,奥希替尼)进行一线或二线治疗后出现疾病进展的NSCLC患者。
治疗EGFR 19号外显子缺失或L858R激活突变,且经奥希替尼或其他获批的三代EGFR TKI治疗以及含铂双药化疗后疾病进展的NSCLC患者。
治疗EGFR 19号外显子缺失或L858R激活突变,未经过既往治疗的局部晚期或进展性NSCLC患者。
国内企业岸迈生物也曾于6月份在AACR年会上公布其EGFR/c-Met 双抗EMB-01的临床前数据,显示EMB-01能同时与EGFR和c-Met结合,并诱导各种肿瘤细胞中两个靶标受体的共降解,而两个单克隆抗体(单抗)的单独或联合使用则无法达到这一效果。与单抗相比,EMB-01还显示出对EGFR和c-Met通路下游信号的更广泛抑制,以及在各种PDX肿瘤模型中更有效和更持久的体内抗肿瘤功效。这种增强的效力可能是由EMB-01介导的肿瘤细胞中EGFR和c-Met的共降解驱动的。