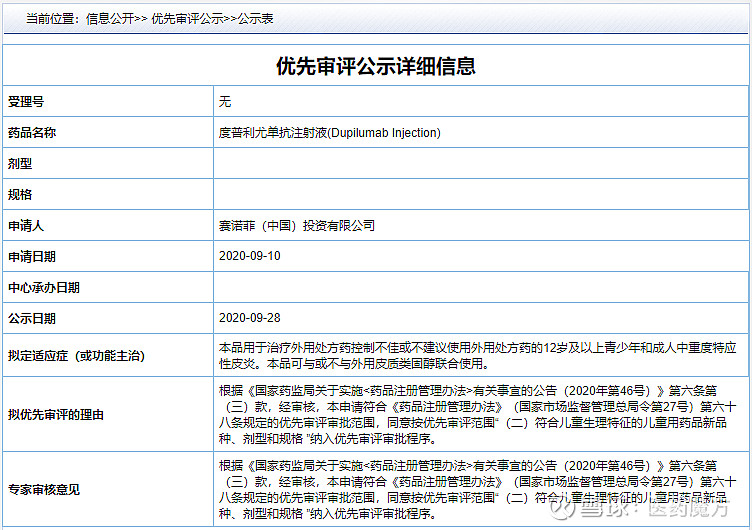
9月28日,赛诺菲在中国提交的度普利尤单抗注射液(Dupixent)第2项适应症上市申请拟纳入优先审评,用于治疗外用处方药控制不佳或不建议使用处方药的12岁及以上青少年和成人中重度特应性皮炎。

Dupixent能选择性的抑制关键信号通路IL-4和IL-13,阻断Th2型炎症通路,降低Th2型炎症的病理性反应,从机制上治疗Th2型炎症相关疾病。
Dupixent是美国批准上市的首个治疗特应性皮炎的生物制剂,于2017年3月首次获得FDA批准用于治疗成人中重度特应性皮炎。此后,赛诺菲又不断拓宽了Dupixent的适用人群年龄,分别在2019年3月和2020年5月获批用于治疗12-17岁青少年以及6-11岁儿童中重度特应性皮炎。另外,针对6个月~5岁特应性皮炎患者的临床试验已进展至II/III期阶段。
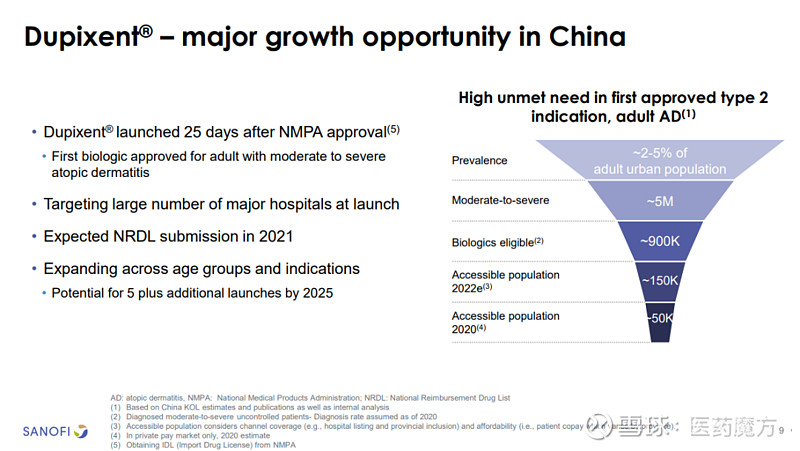
Dupixent于2020年6月首次在中国获批上市,用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度特应性皮炎。财报显示,Dupixent在2020上半年的全球销售额达到16.34亿欧元(+93.8%),赛诺菲计划将其打造为年销售额过100亿欧元的重磅炸弹。
赛诺菲预估Dupixent能于2020年在中国覆盖5万人群,在2022年覆盖15万人群,并计划在2021年推动其纳入中国医保目录,在2025年获得其他5个适应症的批准。