
8月12日,Regeneron公司宣布FDA已经受理evinacumab联合其他降脂药治疗纯合子家族性高胆固醇血症(HoFH)的上市申请(BLA),并对该申请授予了优先审评资格,PDUFA预定审批期限是2021年2月11日。
HoFH是一种超罕见遗传病,美国有大约1300例患者。HoFH患者低密度脂蛋白(LDL)受体功能丧失,造成LDL-C(坏胆固醇)水平严重升高,导致患者在较小年龄就有较高的早发动脉粥样硬化性疾病和心血管事件风险,如果不加干预,HoFH患者通常在20岁左右就会发生动脉粥样硬化性疾病,30岁就会死亡。当前临床指南推荐HoFH患者进行早期强化降脂治疗,但是绝大多数的HoFH患者都对标准的降脂药物(包括他汀类、PCSK9抑制剂)响应不足或者无响应,治疗后平均LDL-C水平仍高于250 mg/dL,显著超过100 mg/dL的安全标准。
Evinacumab是目前研发进度最快的靶向血管生成素样蛋白3(ANGPTL3)的药物,曾在2017年获得FDA授予的治疗HoFH患者的突破性疗法资格。ANGPTL3是参与人体正常脂质代谢平衡的一种调节蛋白,可以抑制脂蛋白脂肪酶(LPL)的活性,而LPL可以水解脂蛋白(如乳糜微粒、极低密度脂蛋白)中的甘油三酯。Regeneron于2017年发表在NEJM杂志上的一篇文章数据显示,ANGPTL3无效突变的人群,LDL-C和甘油三酯水平比普通人低70%。Evinacumab阻断ANGPTL3蛋白其实就是在HoFH患者中复制ANGPTL3功能缺失而带来LDL-C水平降低的效果。

来源:NextPharma
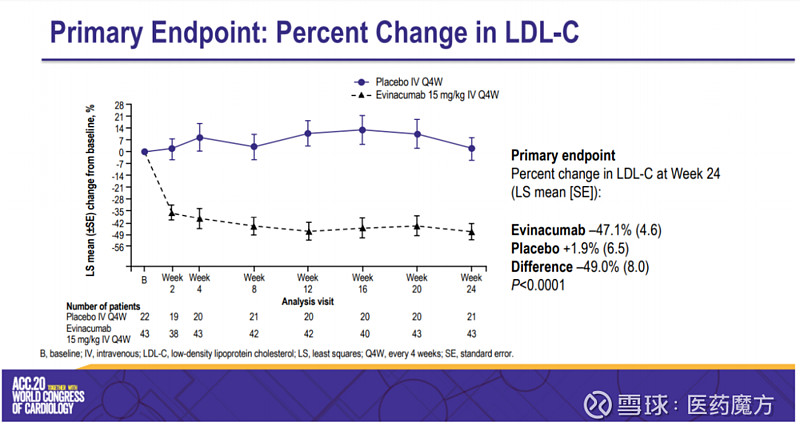
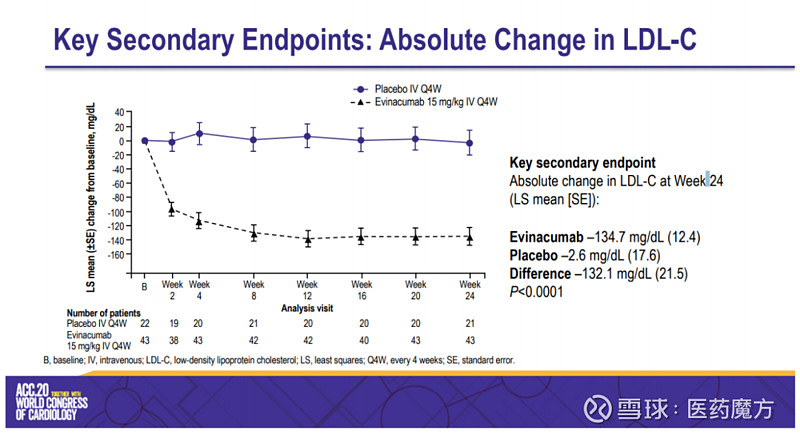
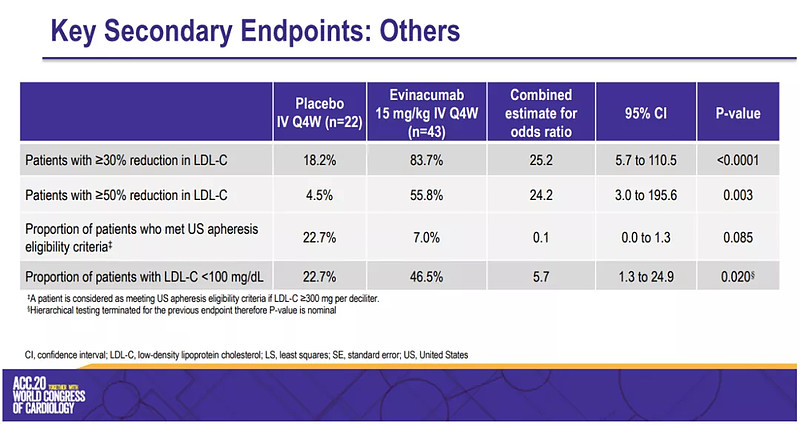
Regeneron此次提交BLA主要基于ELIPSE HoFH研究的数据。该多中心、双盲、关键III期研究入组65例12岁以上HoFH患者,主要评估每4周1次静脉注射evinacumab 15 mg/kg(n=43)和安慰剂(n=22)的疗效和安全性差异,主要终点是第24周LDL-C水平较基线水平下降的百分比。次要终点则包括第24周LDL-C水平下降的绝对值,LDL-C水平下降30%以上和下降50%以上的患者比例、LDL-C水平低于100mg/dL的患者比例等。
结果显示,evinacumab组LDL-C水平较基线降低了47%(降低135mg/dL),安慰剂组则较基线增加了2%(降低3mg/dL),evinacumab相比安慰剂则使LDL-C降低了49%(降低132mg/dL);此外,evinacumab组LDL-C水平低于100mg/dL的患者比例为47%,安慰剂组为23%,不过这个数据未观察到统计学上的意义(p=0.0203);evinacumab组LDL-C水平降低30%以上的患者比例为84%,降低50%以上的患者比例为56%,安慰剂组这两组数字分别为19%和5%。
evinacumab目前还在开展针对HoFH患者的III期扩展研究,针对难治性高胆固醇血症的II期研究,以及针对严重高甘油三酯血症的II期研究。evinacumab在欧盟的上市申请也正处于审评之中,今年6月EMA 人员药品委员会建议对evinacumab的上市申请进行加速评估,这主要是考虑到临床上的未满足需求以及evinacumab产品本身的创新性。
新靶点降脂药的开发难度越来越高,Regeneron此前与赛诺菲合作开发上市的PCSK9单抗药物Praluent(alirocumab)是降血脂领域的里程碑式产品,最早上市的适应症是杂合子家族性高胆固醇血症(HeFH),2019年底与赛诺菲修改合作协议后,Regeneron目前拥有alirocumab在美国市场的独家开发权益。临近上市的evinacumab首推的适应症是纯合子家族性高胆固醇血症,不管后续市场业绩如何,作为first in class都称得上是降血脂领域的又一款里程碑式产品。
相关阅读