
文 | 田文志 宜明昂科创始人
近年来双/多靶点抗体成为了生物药领域研发的热点,从国外到国内几乎所有的生物药研发公司都在布局双/多靶点抗体项目,既有技术平台的研发,也有基于他人技术平台进行的药物开发。本文就个人对该领域的理解,谈一下研发双/多靶点抗体的科学思路及对未来发展趋势的看法。
双靶点抗体(简称“双抗”)是指一个抗体分子同时靶向两个抗原或者靶向一个抗原的两个不同的抗原表位。由于疾病(尤其是肿瘤)的复杂性,靶向一个疾病抗原往往疗效有限,同时由于靶向两个疾病抗原的抗体联合应用时带来较好的协同效应,促进了人们对于“双抗”的热衷。
至今获得批准上市的“双抗”药物有3个。一个是Catumaxomab,靶向EpCAM和CD3,于2009年在欧盟获批上市,用于治疗晚期卵巢癌腹水患者,由于疗效欠佳已于2017年6月撤市。
第二个是Blinatumomab,靶向CD19和CD3,分别于2014和2015年获得美国FDA和欧盟EMA批准上市,用于治疗急性B淋巴细胞白血病。
第三个是Emicizumab,靶向凝血因子IX和X,分别于2017年11月和2018年3月获得美国FDA和欧盟EMA批准上市,用于治疗A型血友病(编辑注:Emicizumab已于2018年12月在中国上市)。目前处于临床试验阶段的“双抗”药物有57个。

关于双抗平台的思考
处于研发阶段的“双抗”技术平台有许多,大致可以分为两大类:一类带有Fc,另一类不带有Fc。带有Fc的“双抗”技术平台包括TrioMab、Crossmab/KIH、DVD-Ig、IgG-scFv、FIT-Ig、mAb-Trap等。不带有Fc的“双抗”技术平台包括BiTE、DART、TandAb、ImmTAC、TriKE等。
带有Fc的技术平台具有纯化方便、稳定性好等优势,但劣势是有些结构(比如Crossmab/KIH)CMC较为复杂,多半会有较高的聚体、错配、纯化得率低等问题。另外,如果分子量过大,对肿瘤组织的渗透性会比较差。
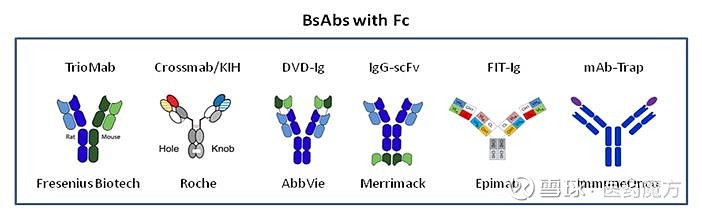
带有Fc的技术平台
不带有Fc的技术平台多半是基于CD3抗体设计的两个单链抗体的链接,具有产量高、临床剂量小等优点,但由于不带有Fc,基于Protein A的常规的纯化技术就无法用了,必须开发特定的纯化技术路线。另外,该类分子的半衰期比较短,只有几个小时(比如Blinatumomab,只有2个小时),需要频繁用药。

不带Fc的技术平台
经过临床验证的“双抗”技术平台有3个:TrioMab、Crossmab/Knock-Into-Hole、及BiTE,由于Catumaxomab已经撤市,所以严格来讲只有2个“双抗”技术平台获得了临床验证。其它平台产品均处于早、中期临床试验阶段。
在设计自己的“双抗”分子时,需要综合考虑多种因素(适应症、对应靶点、及药代等)。
以适应症为例,如果是针对自身免疫性疾病(比如RA、银屑病)或者血液肿瘤,则由于疾病靶点(多半是细胞因子,比如IL-1、IL17、IL-23、TNF-a)或者癌细胞均在血液中游走,可以不考虑药物的渗透性问题,设计时可以选择带有Fc的分子结构。
而如果是针对实体肿瘤(比如肺癌、胃癌、大肠癌等),过大的分子量有可能影响到“双抗”药物的生物利用度,并因此而影响疗效,所以分子设计时应充分考虑到体内的药代问题,必要的话应先做一个药代预实验,以确保药物的组织渗透性及相应的生物利用度。
总之,对于“双抗”分子结构的设计,应以“大道至简”为原则,尽量确保分子的结构不出现聚体、没有错配、保证纯化得率、以及良好的药代。

关于靶点选择的思考
在选择“双抗”分子的靶点时,应基于科学认知及实验验证的结果来确定。如果是针对肿瘤的“双抗”药物,应考虑2个靶点的生物学功能,一般情况分为3种:
2个靶点都在肿瘤细胞表达;
1个在肿瘤细胞、1个在免疫细胞;
2个都在免疫细胞。
2个靶点都在肿瘤细胞的“双抗”药物还没有获批上市,目前都处在临床试验阶段。主要包括Duligotuzumab(MEHD7945A,靶向EGFR/Her3),MM-111(靶向Her2/Her3),LY3164530(靶向Met/EGFR),JNJ-61186372 (JNJ-372,靶向EGFR/c-Met),ABL001(NOV1501,靶向VEGF/DLL4)等。
进展最快的是Duligotuzumab,完成了临床II期,然而遗憾的是该试验以失败而告终,并没有达到临床试验终点。而LY3164530也因EGFR抑制相关的毒性而终止了临床试验。
基于CD3靶点的“双抗”药物有一个获批上市(Blinatumomab),其它34个处于不同的临床试验阶段,其中包括18个血液肿瘤靶点,16个实体肿瘤靶点。针对2个靶点同处于免疫细胞(主要指T淋巴细胞)的“双抗”分子主要包括MGD019(DART,靶向PD-1/CTLA-4),目前刚刚进入Ⅰ期临床试验,还没有结果出来。
我个人认为,开发针对肿瘤适应症的“双抗”药物,应关注以下几个方面:
从肿瘤微环境入手,分析每一种实体肿瘤的微环境特征;
着眼于现有免疫检查点抗体药物的低反应性及耐受性;
应结合肿瘤细胞和免疫细胞两方面来考虑“双抗”分子的设计;
单纯针对肿瘤靶点的“双抗”药物目前还未有成功案例;
单纯针对免疫细胞靶点的“双抗”药物目前也没有成功案例;
如何增加肿瘤微环境中免疫细胞的数量(结合趋化因子);
如何减少肿瘤微环境中免疫抑制细胞的数量(Treg、M2)。

未来趋势
由于“双抗”药物具有特定的药效优势,未来一定会出现蓬勃发展的局面,尤其是随着Blinatumomab及Emicizumab被市场及业界的逐步认可,基于科学机制(比如基于2个单靶点抗体的协同效应,基于功能性分子的替代)开发的“双抗”药物一定会有光辉的前景。
但这并不是说随便就可以研发出一个重磅炸弹级别的“双抗”或“多抗”药物,尤其是对于“多抗”药物,成药性应该是比较大的问题。
比如在今年的ASCO摘要中,有一项摘要公布了我国科学家计算设计的新型四特异性抗体(PD-1/ CD47 / VEGF / TGF-β),从理论上来说,多靶点就意味着多种靶点相关的生物学活性,可能会出现更好的疗效,但同时也一定会出现更严重的临床安全问题。
但从科学思维的角度出发,短时间内我不认为“多抗”药物会成为一种趋势,因为这涉及到许多无法逾越的科学难点,比如多靶点人源化小鼠模型的建立,能否有效地用来做体内药效评估就很成问题,更不要说大动物安全性评价研究了。
参考文献
1. Christian Klein, Wolfgang Schaefer, and J€org T.Regula. The use of CrossMAb technology for the generation of bi- and multispecific antibodies. MABS. 2016, VOL. 8 (6):1010–1020
2. Frans V. Suurs , Marjolijn N. Lub-de Hooge , ElisabethG.E. de Vries, Derk Jan A. de Groot. A reviewof bispecific antibodies and antibodyconstructs in oncology and clinical challenges. Pharmacol Ther. 2019, S0163-7258(19)30069-5.