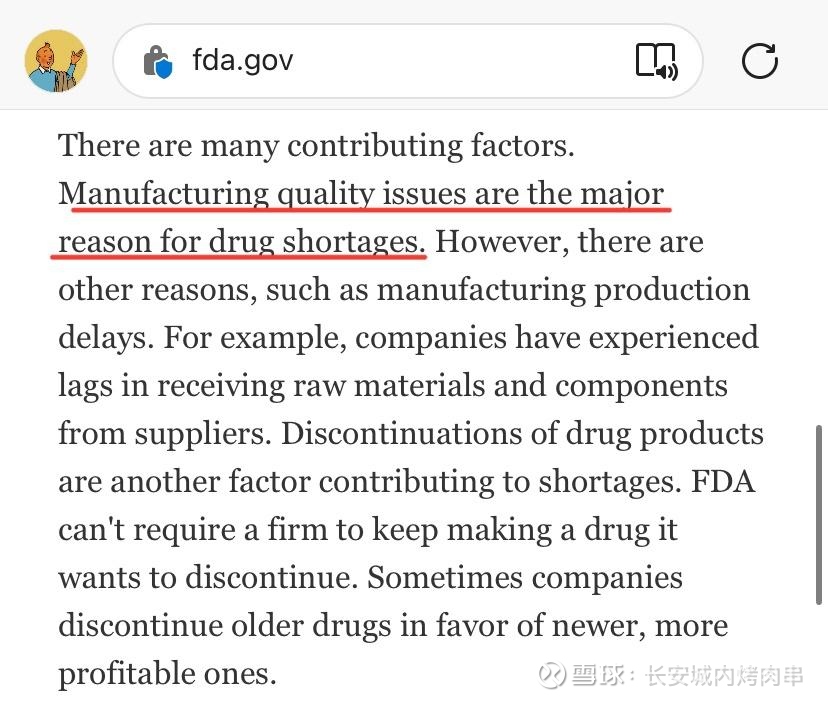

| 发布于: 修改于: | 雪球 | 回复:9 | 喜欢:1 |

找到一份FDA的关于新药和生物制品上市审批流程。甘李估计现在绿色中间那块---CBER生物评价研究中心审查。CBER审查完成后,就是额外的FDA审查、和最终完成批准。
@乘风起云飞扬:FDA Form483 notice回复期限是15个工作日之内,如果后续没有收到FDA warning letter,应该是整改进行地比较顺利。
这个是去年球友的答复,当时查过483应该不算大的问题,后续也没有警示函,当时感觉应该没有二次现场检查了,你说二次审核是有什么新的信息吗?