


“中国新药上市的数量已经连续第六年超过30款,近五年来,在全球上市的新药总数仅次于美国。这意味着,在中国,无论是肿瘤患者还是其他疾病领域的患者,已经可以同步使用最先进或最有效的创新药,甚至在个别领域超越了欧美国家。
对老百姓来说,我们不必再像以前那样谈癌色变,肿瘤病人的寿命得以延长,也有许多肿瘤基本上已经达到可以临床治愈的水平。”

怀着对挽救肿瘤病人生命的极大使命感,临床肿瘤科医生出身的邹建军已经在这个领域深耕了近30年,见证了医疗临床实践、药物研发和医药行业的演变与发展。几周前,她来到【泉果无限对话】进行分享,她说,从产业的视角来看,中国创新药的发展,是一个数量和质量双轮驱动的过程,现在已经进入了高速发展期。
邹建军现任君实生物总经理兼首席执行官。君实生物是中国在PD-1抗癌药领域的“四小龙”之一。
*PD-1抑制剂是一种利用人体免疫系统抵御肿瘤的治疗方法,通过阻断PD-1/PD-L1信号通路,使T细胞恢复杀灭癌细胞能力。
以下为邹建军分享实录精选:
上个世纪80年代,我曾经在肿瘤科做了10年临床医生。那个年代,在肿瘤科做医生是很沮丧的,因为没有足够的救治方案,病人生存时间并没有显著延长。
这让我非常挫败,经常陷入无力感,特别是看到非常年轻的病人离世时。我那时总会萌生一个想法,如果去做药物研发,是不是就能从根本上为病人带来更多希望……
我从很小的时候,梦想就是当医生,所以我非常非常努力。
1989年,我进入解放军第四军医大学,穿上了军装。6年后毕业,去了解放军301医院的临床肿瘤部,做了5年肿瘤科临床医生。后来,我又考入了解放军第二军医大学硕博连读,在临床又待了5年。所以,我真正在肿瘤科临床上做了10年医生。
那个年代,在肿瘤科做医生是很沮丧的,因为没有足够的救治方案,病人来了,大抵就是化疗和放疗。尽管已经有了化疗药,但对于病人来说,即使是早期肿瘤病人,生存时间并没有显著延长。
这让我非常挫败,经常陷入无力感,特别是看到非常年轻的病人离世时。所以,我那时总会萌生一个想法,如果去做药物研发,是不是就能从根本上为病人带来更多希望……
博士毕业后,我加入德国拜耳公司,负责了拜耳在中国第一个肿瘤药物——索拉非尼的临床研究,这也是中国第一个获批的针对肝癌的靶向治疗药物。我先后在拜耳、新基,陆续负责了多个肿瘤药项目的开发上市,在外企又做了10年。

2015年,一次机缘巧合,恒瑞医药的孙飘扬董事长找到我,说:“邹博士,你做了10年医生,又在外企工作了10年,也主导或参与过一些药品的成功上市,是时候回到民族制药企业,为中国老百姓做药了。”就是因为这句话,我加入了恒瑞。恒瑞这个平台非常优秀,孙董事长是一个提前20年布局创新药转型的企业家。我在恒瑞工作的7年间,有幸和团队一起,在孙老板的带领下,开发了10个创新药,现在都已经陆续成功获批了,造福于广大的患者。
2022年,我加入了君实医药,负责全球创新药的研发工作。今年1月,正式接任CEO的工作。
从临床医生到医药研发,从外企到民族制药企业,从一线员工成长为管理者,最终带领全球团队,这一路的经历对我的成长至关重要。我也从不同的维度,见证了中国创新药的发展和崛起。
所以,今天我以业内人士的角度,和大家交流一下我的思考。

西风东渐:中国创新药进入高速发展期
纵观中国创新药的发展,经历了几个不同的阶段。
图1. 中国创新药的发展阶段

来源:邹建军博士在泉果无限对话的分享
改革开放初期,那时我还是医学院的学生,中国很少有创新药,医药行业主要集中在仿制药的生产和技术引进上。国内药物的上市落后于国际十年,甚至二十年。
从2000年开始,随着经济的发展与一系列政策的出台,创新药的发展明显加速。我们能明显感受到,最近10年,中国创新药进入了一个高速发展阶段,中国创新药企业开始在国际上崭露头角。
中国新药上市的数量已经连续第六年超过30款,近五年来,在全球上市的新药总数仅次于美国。
这意味着,在中国,无论是肿瘤患者还是其他疾病领域的患者,已经可以同步使用最先进或最有效的创新药,甚至在个别领域超越了欧美国家。
对老百姓来说,我们不必再像以前那样谈癌色变,肿瘤病人的寿命得以延长,也有许多肿瘤基本上已经达到可以临床治愈的水平。
图2. 中国新型活性物质(NAS)的上市情况,2014-2023年
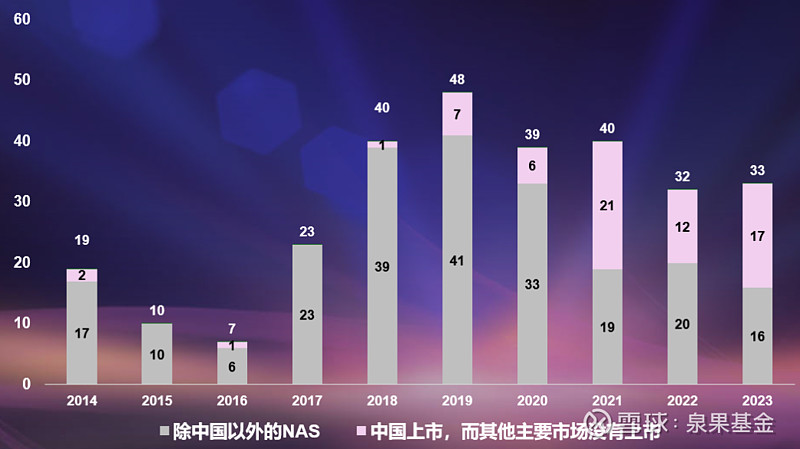
来源:邹建军博士在泉果无限对话的分享
数据来源:Global Trends in R&D 2024
临床研究是从实验室转化为可用于临床药物的最后一步。所有的新药都必须经过临床研究,证明其疗效和安全性,才能获得上市批准。从整体上看,近15年来,全球和中国每年完成的临床项目数都在快速增长。除了本土药企,一些国际药企也在中国开展了大量的临床研究。
图3. 全球vs中国每年新增与完成临床项目数,2009-2023年
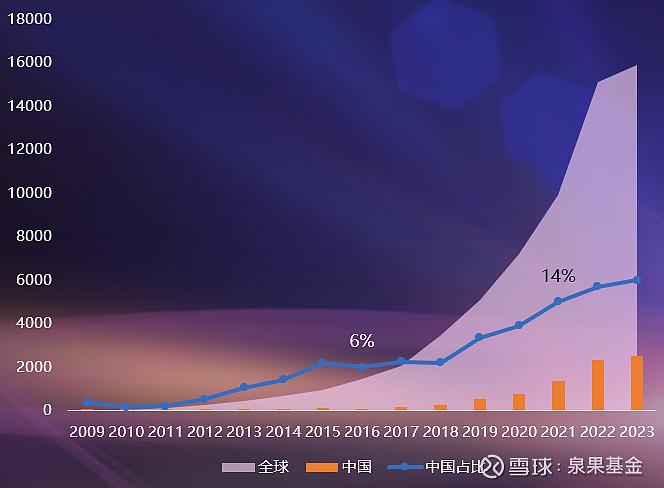
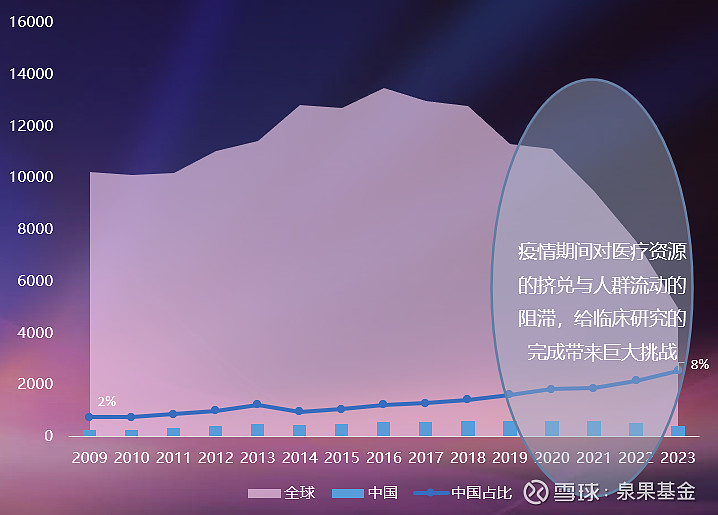
来源:邹建军博士在泉果无限对话的分享
药物研发的地域性也呈现“西风东渐”的趋势。一年前,在参与制药研发的所有公司中,大约40%的公司总部在美国;但现在这个数字已经下降到39%。与此同时,中国药企的比例从13%上升到16%。
图4. 制药研发公司总部地域占比,2023 vs 2024年
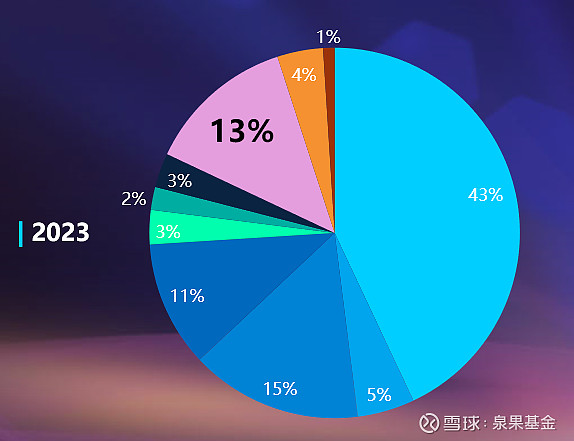
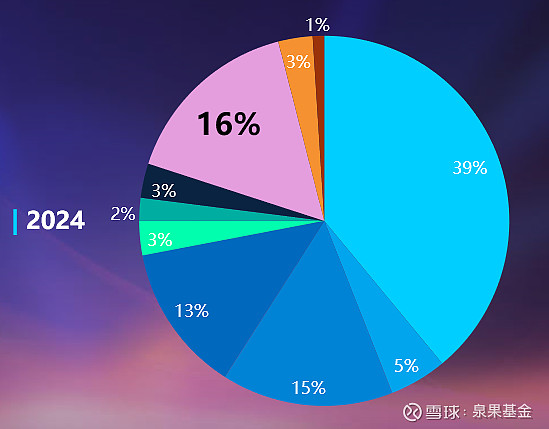

来源:邹建军博士在泉果无限对话的分享
数据来源:Pharmg R&D Annual Review 2024
过去五年中,我们在研药物的数量也在持续增长,研发管线数量自2019年以来增长超200%,中国在全球活跃药物研究中的贡献已经位居第二。未来会有越来越多的创新药在临床上证明疗效和安全性,从而获得批准。
图5. 中国研发管线总规模,1995-2024年
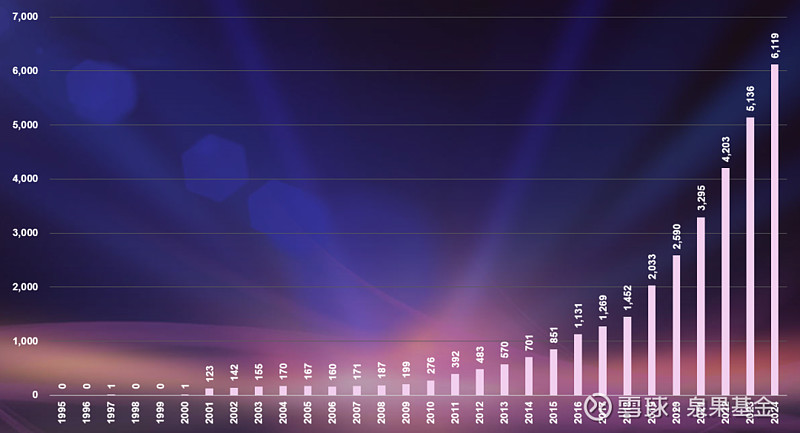
来源:邹建军博士在泉果无限对话的分享
数据来源:Global Trends in R&D 2024
创新药的发展是一个双轮驱动的过程,除了数量与效率上的显著提升,还有不断“提质”的过程。
不知道大家是否了解2015年医药界的“722事件”。
当时药物研发的质量参差不齐,国家要求药企进行自查整改,许多药企都撤回了新药的上市申请。
因此,“722事件”被称为“史上最严的数据核查要求”,使用了“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”作为要求。
之后,国家监管力度明显增强。现在药物想获批上市,需要经过非常严格的质量审查。无论是企业还是药监部门,对整个临床开发过程都有严格的监管标准。仅2023年,药监局就出台指导原则57项,规范和引导新药研发程序、促进创新生态。
大家对制药这件事,越来越充满敬畏之心。作为制药人、作为医生,都要对生命要有敬畏。国内大部分企业都是按照这个标准开展临床实验和工作的,“722事件”后,获批上市的药物质量也得到了严格的保证。


出海路径:制药体系正与国际接轨
如果大家关注医药板块,会发现中国创新药“出海”的报道十分频繁。
去年底到今年初,很多大型药企到中国来“扫货”,实现了几个重大的交易。中国创新药企业越来越多地参与到国际市场中,包括一些还在初创阶段的企业,甚至有些还处于实验室阶段的分子就能够被交易给国外的大企业,这表明中国许多制药企业,其创新性、先进性及质量,都在向国际水准靠拢。
图6. 医药交易数量及金额统计,2019-2023年(亿美元)
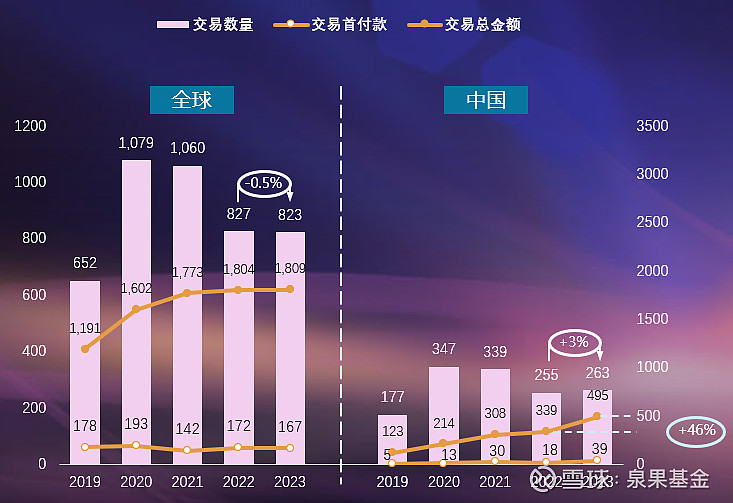
来源:邹建军博士在泉果无限对话的分享
图7. 中国医药交易转让关系统计,2019-2023年
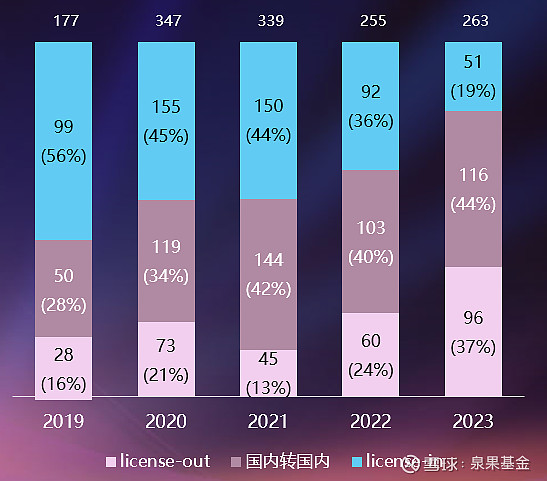
来源:邹建军博士在泉果无限对话的分享
交易转让模式的“出海”策略,一般分为license-in和license-out。
*License-in,又称许可引进,是通过向产品授权方支付一定首付款,并约定一定金额的里程碑付款及未来的销售提成,从而获得产品在某些国家地区的开发、生产和销售等商业化权益;
*License-out,又称对外授权,模式是指企业进行药物早期研发,然后将项目授权给其他药企做后期临床研发和上市销售,按里程碑模式获得各阶段临床成果以及商业化后的一定比例销售分成。
如果中国企业已经将分子开发出来或已在临床前验证阶段,大企业就可以采取license-in的方式,向中国企业购买一个现成的分子,直接进入到临床后期开发,提高效率。
license-out交易大多是临床后期或者已上市的产品,会被认为是创新走出国门有力的印证,尤其是与跨国大药企的合作更加受到关注。可以看到,近几年的相关交易中,license-in交易数量大幅降低,已降至20%以下,而license-out交易数量快速提升。
近年来,大家都在谈论“抱大腿”。实际上,对于国内制药企业来说,融资困难的情况下,采用这种方式让企业有更多的空间和余地,投入到新药的研发工作。

除了交易转让,近年来,还有另一种主流的“出海”路径——中国自己研发的药物,直接走出国门,获得FDA(美国食品药品监督局)、欧盟等海外监管机构的认可与批准。
近年来,多款中国原研创新药获得了FDA的批准,有百济神州的泽布提尼、君实生物的特瑞普利单抗等。
图8. 已在美国FDA获批与即将获批的中国原研创新药与生物类似物
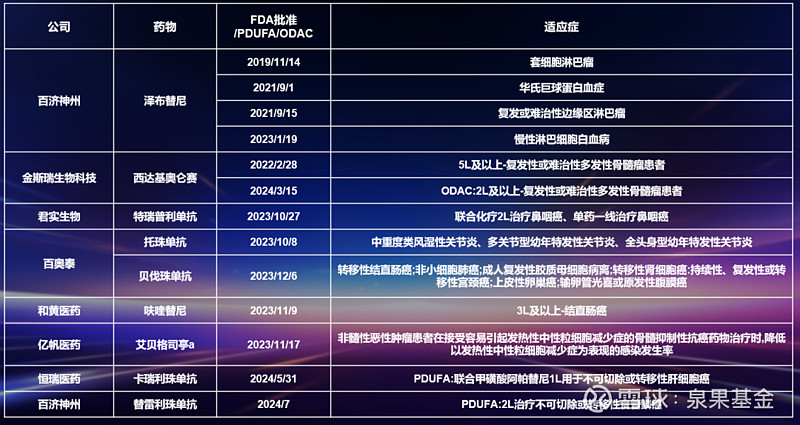
来源:邹建军博士在泉果无限对话的分享
2023年,超40款中国新药获得了FDA的资格认证,证明了中国创新药得到了最严苛监管机构之一的高级别认可。这里的分类涉及一些专业术语,比如“突破性疗法”、“快速通道”、“孤儿药”等。有了这些资格认定,FDA会认为其具有独特性、创新性以及突出的疗效和安全性,批准时间将大大缩短,一些药物还会获得更长的专利保护期。
图9. 2023年超40款中国新药获美国FDA资格认定

来源:邹建军博士在泉果无限对话的分享
数据来源:药明康德整理,各公司公开新闻稿,统计截至日期:2023年12月12日
我可以简单分享一下,君实的特瑞普利单抗在FDA获批的过程。
在美国,鼻咽癌算是罕见癌症,患者通常会按照头颈癌的标准进行化疗和放疗。FDA之前也从未批准过任何药物治疗鼻咽癌。
去年的10月27号,FDA批准了君实研发的特瑞普利单抗,并给出了两个适应症,基本覆盖了鼻咽癌晚期的全线治疗:单药可以用于二线及以上的鼻咽癌患者;如果病人发现时已经是晚期了,可以作为化疗的联合用药。批准当天,FDA在官网上发布了一条公告,宣布这是有史以来美国第一款用于治疗鼻咽癌的药物。美国国家癌症研究所(NCCN)的治疗指南也将其列示为“一类推荐”。
FDA会审查你所有的临床实验标准及执行过程,也会严格审查整个生产体系,GMP(Good Manufacturing Practice,生产规范),GCP(Good Clinical Practice,临床实践规范)和GLP(Good Laboratory Practice,非临床实验室规范)等,这些标准都是全球统一的。所以,这不单是临床研发团队的工作,而是全公司的体系搭建、对质量规范的理解、对质量标准的要求,以及对临床实验管理标准的要求的共同合作的结果。欧盟的审查也是如此。
所以,我们算是通过了世界上最严苛的两个监管机构对生产质量和临床体系的核查的公司之一。我相信,国内很多公司也都可以通过审查。从这个角度看,中国的制药体系已经基本与国际标准接轨。

融资困难:“管好钱”成为第一要务
现在医药板块的股价,应该让大家非常焦虑。
全球生物医药行业的融资水平已经回到了疫情前,所谓的新常态和理性判断周期,融资变得非常困难。查看数据显示,相较于鼎盛时期,中国的晚期募资已下降了87%,美国和欧洲也在下降。
图10.全球生物医药总融资金额,2014-2023年(十亿美元)
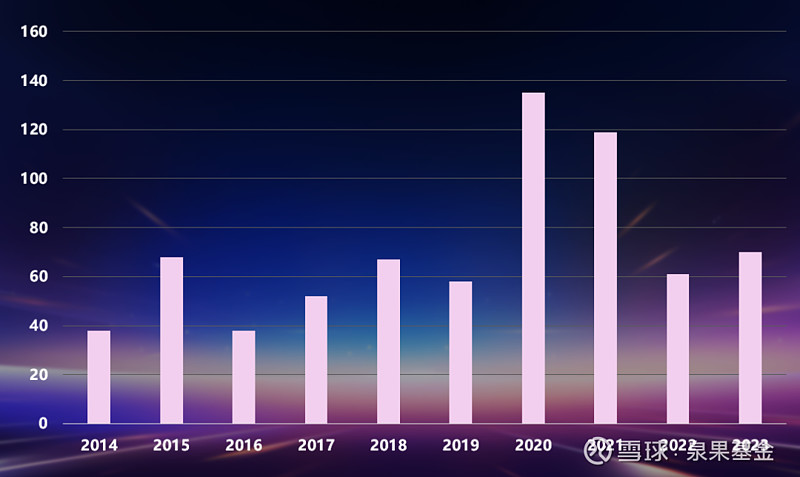
来源:邹建军博士在泉果无限对话的分享
注:融资包括风险投资、首次公开募资、后续融资等
数据来源:科睿唯安Bioworld
对企业来说,如何在这样一个充满挑战的环境下,走出一条具有差异化的道路,是每一个企业管理者面前的重要问题。
君实不能算是创业阶段,但我们确实还在发展的早期阶段,还没有实现盈利,仍然依赖融资来支持药物的研发和投入。所以作为CEO,我的第一要务就是“管好钱”,把资源聚焦在最擅长的、未来最有可能实现突破的领域。
目前,君实的单抗和双抗平台已经相对成熟。单抗进入了全球三期临床阶段,是目前全球唯一一个,我们非常期待这个产品未来能取得好的结果。除此之外,像ADC(抗体药物偶联物)等热门技术路径,我们也有布局,预计今年底或明年初会有多个产品申报临床。小分子药物、核酸类药物,我们也都有布局。

但我们的策略很清晰,由于资源有限,我们不能铺的很广,要确保做的是那些真正具有差异化竞争优势、在全球范围内有开发潜力的分子和适应症。
在肿瘤领域,有句话叫“得肺癌者得天下”,所以几乎PD-1产品都布局了肺癌的适应症。作为一家中国企业,我们希望能满足中国患者的需求,未来在适应症的布局上,还将重点关注中国其他的高发疾病,如肝癌、食管癌和胃癌等。
那些只能在国内开发的产品,由于国外的治疗标准已经非常高,中国的药物开发竞争也相当激烈,可能不具有开发潜力。因此我们会优先考虑那些具有全球开发潜力的分子,聚焦在中国和全球高发疾病的治疗上,这是我们的整体布局和策略。
我们也在探索通过寻求多方合作,实现商业价值的全球化。前面提到的特瑞普利单抗,除了在美国获批上市外,我们也向欧洲、澳大利亚、新加坡等地提交了申请,预计今年年底在这些地区都能获批上市。同时,我们也响应了一带一路倡议,寻找了多个商业合作伙伴,负责特瑞普利单抗在55个东南亚国家的商业化。

出海,也是创新药行业的“管好钱”的行动。
以君实的特瑞普利单抗为例,美国的定价是中国的33倍,是目前为止中美价差最大的药品之一。所以许多同行都在呼吁中国的定价体系改革,因为我们的药物在中国真的卖得太便宜了。
医药圈流行一句话:“开发一款药需要遵循‘double ten’原则,即投资十亿美金,花费十年时间。”在中国十亿美金有点夸张,十亿人民币差不多,但如果是全球范围的研发,真的需要这么多资金。早期药品研发会耗费大量的人力、物力和财力。药品上市后,如果没有纳入医保,定价能稍微高一些,但这个回报也远远不足以覆盖早期的投入。一旦被纳入医保,价格会被“打骨折”。

同时,在靶点开发上的内卷问题,实际上也是创新药企业面临的另一个挑战。当一个靶点一旦被证明可能有效,大家就会一窝蜂地去开发。虽然目前在国内已经有18个PD-1/PD-L1类药物获批,但还有很多在临床开发阶段,且布局的适应症高度雷同。这样的话,每一个产品能有多少商业回报?企业必须评估,是否还值得继续开发。
所以很多企业都在呼吁,包括成熟的药企,按照现行的医保定价规则,企业的早期研发投入根本无法获得相应的商业回报,进而缺乏资源进行进一步的研发投入。如果政策能给企业更合理的定价权,使企业能在商业回报上得到足够的支持,来进行下一步的研发投入,对中国的医药市场和创新药企业的长期发展,非常重要。
但是我觉得也不必过分焦虑,导致动作变形。我们需要回归创新药其本应有的价值,真正去解决临床上未满足的需求和患者的问题。这确实是医生或药物研发人员需要静下心来考虑的。中国有句古话说,“民以食为天,药为地”,如何使企业能聚焦于解决未满足的医疗需求,开发出能真正解决老百姓或患者实际问题的药物,这也是我们每一个药物研发人员的梦想。

战略执行:人才是最重要的资产
上边我提到了一些专业研发领域布局的战略。然而,在现实的研发中,不同的公司聚焦于同一款产品,速度也不尽相同,因为这还涉及到一些执行层面的方法论。
首先,临床开发计划必须非常具有前瞻性和战略性。
举个例子,当时在恒瑞,我们开发的PD-1在审批时花了更多时间,批准时落后于其他两个PD-1。这时,就非常考验团队的战略思维和临床推动能力。
在进行PD-1的临床布局时,通行的做法是,先布局一个单臂小适应症,因为从政策层面,可以加快获批进度。但如果等它完成后,再扩展适应症,会很慢。更有效率的做法是,推进小瘤种快速获批的同时,同步布局大的瘤种。当时我们就是这么做的。所以,虽然我们的PD-1是第三个获批,但在头两年,获批了8个适应症,抢占市场先机非常关键。

这还关乎推动临床效率的问题。任何企业,不论老板多么有前瞻性和战略眼光,如果没有人执行,那么一切都是空谈。所以我总是强调,人才是公司最重要的资产。这么多年来,我一直很幸运,因为我的团队一直都很优秀。
现在作为管理者,我的经验是,我们需要以身作则,要求团队做到的,自己一定首先要做到。我是一个非常强调自我管理的人。我一直特别喜欢那句话:“你若决定灿烂,山无遮,海无拦。”这完全取决于你对自己有什么要求。我给自己设定每天完成一小时的有氧运动,五点多起床,六点开始运动,运动完了去上班,坚持了很多年。运动给我带来了很多好处,让我更健康、更挺拔,让我拥有旺盛的精力和体力,能够在处理繁杂的工作时,保持敏锐的头脑和清晰的思考。

我做临床医生10年,外企待了10年,原本打算在恒瑞工作10年后退休。很多人问我,为什么第7年离开去了君实?我后来意识到,我用7年的时间提前完成了自己的规划。加入中国的创新药企业,意味着走出舒适区,接受新的挑战。这条路也让我从一个纯粹做研发的人,变成了一个责任更加重大的公司管理者。
官宣成为君实CEO那天,有一些媒体发文质疑说“‘研发一姐’能否接住这个盘子?”
说实话,研发是我驾轻就熟的领域,我有信心、有成熟的团队,但成为一个真正的企业管理者,确实是一个全新的挑战。在创新药企工作,会面对与成熟本土企业完全不同的情况和挑战,思路也必须不同。但我会竭尽全力,努力做一个成功的转型者。


法律声明
本资料不作为任何法律文件,不代表泉果基金的任何意见或建议,不构成泉果基金对未来的预测,所载信息仅供一般参考。前瞻性陈述具有不确定性风险,泉果基金不对任何依赖于本资料而采取的行为所导致的任何后果承担责任。