本月初艾德生物官宣MSI试剂盒获批上市,是首个泛癌种免疫治疗伴随诊断试剂盒。做为艾德生物的主要竞争对手,世和基因和泛生子以及燃石医学近期其实也都有动静出来,值得研究关注。
今年10月12日,世和基因(北陆药业参股,已申报科创板上市)的“非小细胞肺癌组织TMB检测试剂盒”(世和一号)获批上市。根据公司公告,该产品主要针对EGFR基因突变阴性、ALK阴性的非鳞状非小细胞肺癌患者,用于体外定性检测经福尔马林固定的石蜡包埋组织样本中的肿瘤突变负荷(TMB)。TMB是一个免疫检查点抑制剂治疗疗效预测标志物,“世和一号”通过高通量测序技术检测425个基因,以此得到TMB数据。
世和一号获批的消息引发了NGS业界的高度关注,认为这是国内第一张大panel的NGS注册证。
国内基因检测的公司主要有燃石医学、诺禾致源、艾德生物、世和基因等,此前获批的产品最多只有10个基因,属于小panel的NGS检测产品。世和一号本次获批在国内NGS监管层面和业内NGS研发层面都属于一个突破。
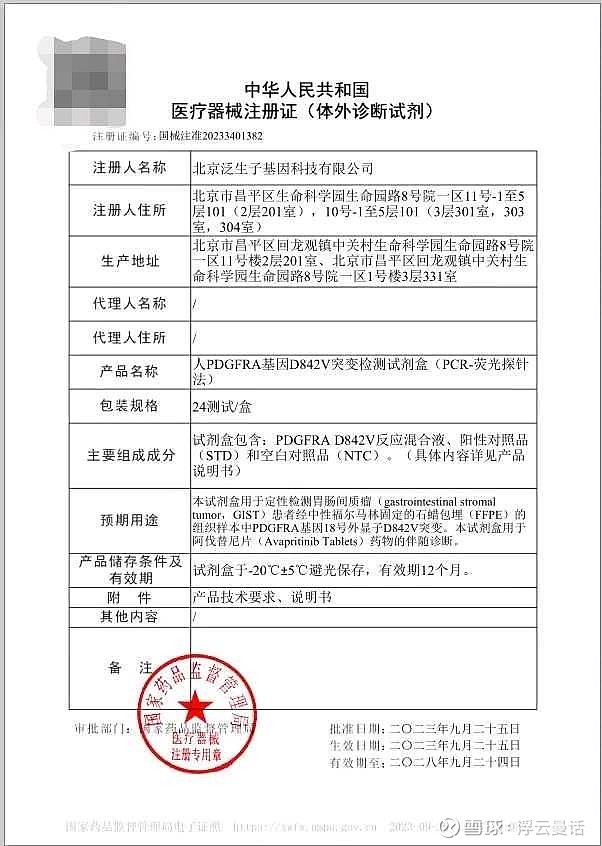
在伴随诊断报证获批方面,泛生子也取得了重大进展。今年9月25日,经过三年不间断的研发与临床验证,泛生子注册的“人PDGFRA基因D842V突变检测试剂盒”(国械注准20233401382,以下简称“试剂盒”)获国家药品监督管理局(NMPA)批准,成为中国伴随诊断试剂指导原则出台后NMPA批准的首个以桥接路径开发的伴随诊断试剂盒。该试剂盒由泛生子与基石药业联合开发,可通过检测胃肠间质瘤(GIST)患者的PDGFRA基因突变,用于泰吉华®(通用名:阿伐替尼)药物的伴随诊断。从2019年底泛生子和基石宣布合作,面对新冠疫情带来的多重挑战,该试剂盒仅用三年时间便完成从研发到审批的落地。
再补充下燃石医学在伴随诊断和泛癌种早筛的进展。2023年8月9日,燃石医学(NASDAQ/LSE:BNR)宣布与阿斯利康(AstraZeneca,NASDAQ/LSE/STO:AZN)签订中国合作协议。本次与阿斯利康强强联手,燃石医学将依托国际领先的检测技术,以及高质量、规范化的检测能力,在中国开发和商业化阿斯利康乳腺癌和前列腺癌领域相关药物的伴随诊断(CDx),旨在助力临床研究推进并寻求未来的商业机会。泛癌种早筛方面,9月22日,国家药品监督管理局医疗器械技术审评中心(NMPA)发布的《创新医疗器械特别审查申请审查结果公示》中,广州燃石医学检验所有限公司的“人DNA甲基化检测试剂盒(可逆末端终止测序法)”进入特别审查程序。此次进入创新审查程序的该项产品是集肺癌、肝癌、食管癌、胰腺癌、结直肠癌、卵巢癌等六种癌种的早期检测产品,名为燃小安®,这是首款泛癌种早筛IVD产品进入创新通道。
可以看出,基因检测的头部企业都积极的在试剂报证的道路上跑马圈地,虽然各家技术平台和技术优势各有侧重,然而都在殊途同归的面向肿瘤基因检测,后续的市场竞争在所难免。究竟谁在3-5年后还依然能保持竞争优势?实话说,除去疫情期间的核酸检测业务,肿瘤基因检测全行业都不是太景气,这从相关上市公司普遍的业绩和股价能反应出来。疫后复苏,相关上市公司业绩应有改善,然而市场竞争格局会不会有变化,要说今后哪家可以中长期占据市场竞争优势,目前还有点看不清,希望熟悉这一领域的能一起来交流讨论不吝赐教。
看到11月15日微解药有一场直播,“畅谈桥接伴随诊断第一证注册之路”,已预约了届时学习一下,如有体会再来分享。