
文/ 韩璐 编辑/ 陈晓平
2月3日,美国吉利德科学公司(Gilead Sciences)的在研抗病毒药物——瑞德西韦(Remdesivir)正式在中国开展临床三期研究。
瑞德西韦近来备受瞩目,因其在美国一位新型冠状病毒确诊患者的治疗过程中,效果显著。民间开始冠以“特效药”、“神药”的称号。
其实,瑞德西韦并不是一款新研发的药物,只算是制药届的“老瓶装新酒”,其关键化合物GS-441524早在2012年就已公开报道,2016年,吉利德在《Nature》发表了其作用机理以及抗埃博拉病毒的效果。
尽管临床研究刚刚开始,前途未卜,在新型冠状病毒的阻击战前,瑞德西韦的出现,无疑是一道曙光。
1
关键逆转,治埃博拉的“神药”
瑞德西韦的一举成名,来自近日一篇介绍美国首例确诊病例临床特征的研究报告,报告发布在权威医学期刊《新英格兰医学杂志》(NEJM)。
该名在美国的病例,来自一位35岁的男性,不吸烟,除伴有高甘油三酯血症病史外,身体良好。1月19日当天,因为感到身体不适,前往急诊室就诊。
简单梳理发病时间线:
2020年1月15日,患者从武汉探亲返美;
16日,出现咳嗽,一天后出现持续发烧症状,并且感到疲劳;
19日,急诊当天开始,发烧咳嗽之外,出现恶心、呕吐,此后数天分别出现腹泻以及腹部不适;患者体温37.2度,肺部有听诊音,胸片无异常,常见病原体毫无异常;
20日,患者样本检测,确诊新型冠状病毒,开始进入治疗。
梳理治疗手段的话,明确分为三个阶段:
第一阶段:辅助式治疗——生理盐水+恩丹西酮
该例患者住院初期,生理体征稳定,从目前资料看,和一般抗病毒治疗措施无异。
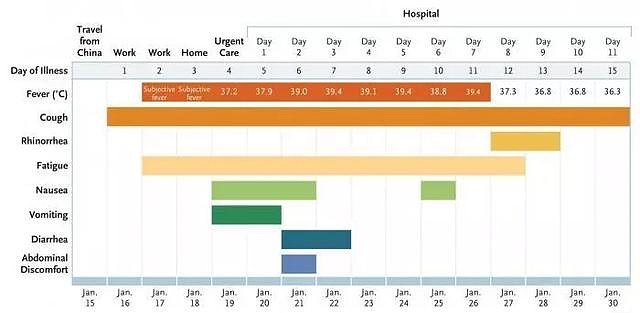
根据疾病日和住院日(2020年1月16日至2020年1月30日)的症状和最高体温
第二阶段:抗生素治疗——万古霉素+头孢吡肟
住院第五天开始,患者持续高烧,肺部出现肺炎特征,呼吸也出现问题。当地医生采用抗生素治疗,并开始为其输氧。
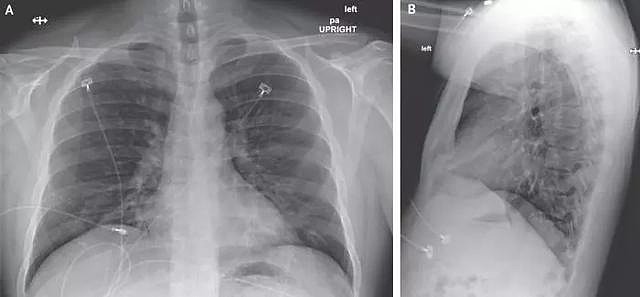
2020年1月22日(患病第7天,住院第3天)的后前胸和外侧胸片。
第三阶段:抗病毒药物治疗——瑞德西韦
1月25日,病程进展到第六天,患者肺部胸片出现明显的非典型性肺炎特征,医生决定启用瑞德西韦;
26日,患者接受瑞德西韦注射,次日,氧饱和度回复正常,不需输氧,其他症状例如腹泻、发烧等也逐渐减缓;
30日,除咳嗽外,患者无其他病情特征,且已退烧。
患者尚未出院,从目前报告进展看,第三阶段启动瑞德西韦,成为历时12天治疗过程中,最关键的逆转点。
同此前数版治疗方案中涉及的已获批药物(针对艾滋病病毒HIV蛋白酶抑制药物:洛匹那韦/利托那韦)不同,这次使用的瑞德西韦,是一款尚未在任何国家获批上市、仍处临床阶段的在研药物。
瑞德西韦为制药巨头吉利德研发,其原本申报的研究方向针对的是埃博拉病毒,由于临床效果与同期多翼实验中的药物相比,并不是最理想,因此暂停试验。

从作用机理看,作为广谱抗病毒药,瑞德西韦是一款核苷酸类似物前药,作用于依赖RNA的RNA合成酶(RdRp),通过抑制RdRp合成,切断病毒复制,起到抗病毒作用。此次新型冠状病毒,便是一款单链RNA病毒,有效性从机理上能说通。
据已公开的临床信息,瑞德西韦在体外和动物实验中,对多种病毒均有抑制作用,包括冠状病毒(SARS病毒、中东呼吸综合症)、丝状病毒(埃博拉)等。此次新型冠状病毒2019-nCoV在结构上与SARS有相似之处,在治疗上,进行尝试也是合理。
在吉利德的声明中,上述美国患者治疗期间,医生也是在权衡风险和潜在收益后,向吉利德提出了用药申请。
2
特事特办,临床加速度
疫情当前,针对新冠病毒的临床试验,正在中国火速上马。
1月31日,美国病例公开报道后,吉利德即发布声明,宣布首席医学官Merdad Parsey博士针对新型冠状病毒正采取药物研发行动,已与全球卫生机构展开合作,提供试验性治疗,其中包括中国疾病预防控制中心、中国国家药品监督管理局(NMPA)。
在该份申明中,吉利德表示,已配合中国卫生部门,“即将开展一项随机、双盲、安慰剂对照试验,以确定使用瑞德西韦时安全有效。”
2月2日上午,《21CBR》记者查询国家药品监督管理局药品审评中心(CDE)时,关于瑞德西韦针对新冠病毒的临床试验申请已被受理,当天中午,中日友好医院发布快讯。
该项临床试验,已在2月3日正式启动,由中日友好医院在武汉开展研究,入组270名轻度/中度患者,预计4月27日实验结束。其进程几乎按天计,跳过临床I、II期,直接进入三期临床获批,特事特办,速度惊人。
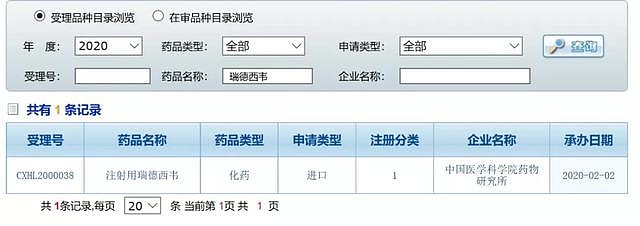
按常规,瑞德西韦在境外完成的是针对埃博拉病毒的临床I、II期试验,如果更换对症病毒,需重新开展I期试验,来验证安全性,这一次,国内直接用以新病毒三期研究,算是重大破格。
“I期一般进行毒性和安全性研究,II期则在小范围进行验证,理论上,不会直接上三期临床,但或许考虑到在其他病毒上,已有临床验证,安全性有一定保障的,加上疫情在发展,等不起。要从头开始做,可能到了三期,疫情结束了,根本做不了了。”一位药物研究人员向《21CBR》解释说。
根据《中国药品管理法》第二十六条,对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项。
作为非常特殊情况处理,这意味着如果证明药物有效,并非一定等4月27日后,才有可能获批上市,进入大规模应用,一旦安全性数据和有效性数据达到条件,就有可能率先进行有条件地获批上市。
风险效益比,应当是此次临床特批中的关键,详细的数据和验证则会持续提供。
目前,吉利德与中方的具体合作方式,官方答复仅是“签订合作协议”。吉利德拒绝向《21CBR》记透露具体专利授权以及后续合作方式。
需说明的是,此前有报道称,美国公共安全卫生部门经特朗普特批,统一将该药物专利豁免,向中国紧急公开药物分子结构,允许中国仿制,此消息不实。
药物结构早已公开,而公开分子结构,并不等同具备仿制合成药物的能力。另外,药品专利若为职务发明,权利人为公司,即便身为美国总统,特朗普也没有权力强制要求企业放弃药品专利权。
3
治丙肝、抗艾滋,期待传奇再现
在瑞德西韦之前,吉利德名字并不熟悉。
这家成立1987年的美国药企,和其他百年药企相比,规模相对有限,全球只有11000多名员工,在2018年,数据分析公司GlobalData公布的全球制药企业名单中,位列第14位,当年销售收入为221亿美元。
创立伊始,吉利德的研发管线聚焦在抗病毒领域,包括艾滋病、肝脏疾病等,现已开始向抗纤维化、细胞疗法以及炎性疾病领域做拓展。
吉利德中国区总经理罗永庆此前告诉《21CBR》,过去30多年,吉利德研发或者商业化的新药近30款,多款成为“爆品”,公众最熟知的抗病毒药物“达菲”,正是由吉利德于1999年研发。
2006年,吉利德又上市第一款单片治疗艾滋病药物Atripla,以前的“鸡尾酒疗法”,艾滋病患者每天要吃一大把药,这款药物病人一天吃一片就可以控制病情,使得艾滋病在药物控制下近乎等同慢性病。

2013年,吉利德上市重磅口服药物“索华迪”,可以治愈丙型肝炎,上市第一年销量就达到百亿美金,公司一跃进入全球制药行业前十。
如今,新型冠状病毒大敌当前,传奇能否在瑞德西韦得到复制,也成为中国普通民众的关切。
毕竟,美国治愈的只是个例,尚不具有普遍性,且瑞德西韦的安全性数据缺乏,治疗成效到底如何,有没有相应副作用,尚需验证。
按照此前的临床认知看,类似感冒、病毒感染这样的“自限性疾病”,药物往往只是对症下药,缓解症状,没有特效药。
即便在美国的这宗病例,病情控制是否与瑞德西韦的使用构成直接强因果关系,也是存疑的,不少人对药物“特效”与否是打问号的。
据罗永庆介绍,吉利德(Gilead)的名字,取自中东一种乳香树,英文为Balm of Gilead,生长在耶路撒冷,其分泌的乳香有治疗作用,公司以此命名代表治愈和成长。
全球化时代,期待Gilead的寓意,也能为战斗在抗疫一线的中国人民带来好运。