我国ADC药物研发起步虽晚,但研发热情高涨。在目前全球公布的400个ADC在研候选药物中,中国企业在研的ADC候选物占据144个。
ADC由抗体、Linker和细胞毒性分子三者组成,兼具特异性抗体的靶向能力、高选择性、稳定性与负载药物的高效抗癌潜力,具有极高的杀伤能力。Mylotarg ®(gemtuzumab ozogamicin)是FDA批准的第一个ADC药物。
目前,全球已有14款ADC药物获批上市,分别是辉瑞的Mylotarg、Besponsa,罗氏的Kadcyla、Polivy、阿斯利康的Lumoxiti、Enhertu,Seagen/武田制药的Adcetris、Padcev,Seagen/Genmab的Tivdak,葛兰素史克的Blenrep、吉利德的Trodelvy、RakutenAspyrian的Akalux,ADCTherapeutics的Zynlonta、荣昌生物的维迪西妥单抗,治疗领域涉及淋巴瘤、白血病、乳腺癌、多发性骨髓瘤、乳腺癌、头颈癌、尿路上皮癌等。
国内已经批准4款ADCs,包括1款国产,3款进口。全球销售方面,最早上市的Kadcyla(恩美曲妥珠单抗)和Adcetris(维布妥昔单抗)合计销售额占全球ADC销售总额超70%,处于领先地位。
国内上市的ADC药物
罗氏的恩美曲妥珠单抗(adotrastuzumab emtansine,Kadcyla)
恩美曲妥珠单抗是由抗 HER2 靶向药物曲妥珠单抗(人源化抗-HER2 IgG1 ),通过稳定的硫醚连接体 MCC(4-[N-马来酰亚胺甲基]环己烷-1-羧酸 酯)与微管抑制药物 DM1(美坦辛衍生物)共价结合,因此,也常被称为“T-DM1”。
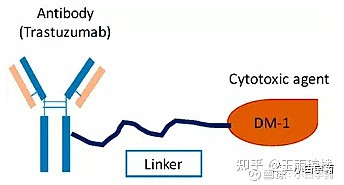
曲妥珠单抗+强效化疗药DM1
图片来源:MDPI
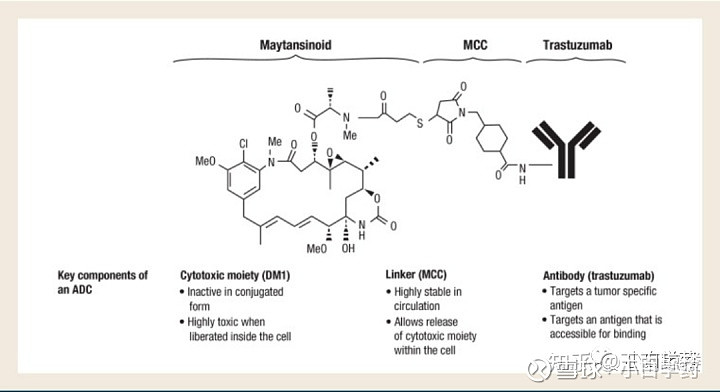
T-DM1药物结构,来源:Trastuzumab emtansine (T-DM1): a novel agent for targeting HER2+ breast cancer.
靶向HER2受体,抑制癌细胞增长,并激活免疫系统。进入癌细胞体内,在癌细胞内部释放强效化疗药,杀死肿瘤细胞。
图片来自:kadcyla 小白学药
T-DM1由罗氏和 ImmunoGen 共同研发,最早于2013年被FDA批准用于治疗,已经接受过曲妥珠单抗和紫杉醇化疗失败的 HER2 阳性晚期乳腺癌患者。
目前有三类免疫疗法已经在乳腺癌中显示了一定的临床疗效,分别是:抗体靶向药物,PD-1/PD-L1 抑制剂,肿瘤浸润淋巴细胞疗法。很多数据都显示,当免疫疗法结合化疗或放疗,可能产生协同效应,增加效果。
说到抗体靶向药物,曲妥珠单抗又名赫赛汀,是抗Her 2的单克隆抗体,它通过将自己附着在Her2上来阻止人体表皮生长因子在Her2上的附着,从而阻断癌细胞的生长,赫赛汀还可以刺激身体自身的免疫细胞去摧毁癌细胞。1998年9月,美国FDA批准了曲妥珠单抗上市。
与曲妥珠单抗相比,T-DM1能将患者侵袭性乳腺癌的复发和全因死亡风险降低50%。2021年恩美曲妥珠销售额19.82亿瑞士法郎,摘得全球ADC销售冠军。
HER2阳性乳腺癌是一种特别具有攻击性的乳腺癌,约影响15-20%的乳腺癌患者。人类表皮生长因子受体(HER),是一族具有酪氨酸激酶活性的高同源性蛋白质,而大约20%的乳腺癌患者会高表达HER2蛋白,此类患者对靶向药物治疗效果良好。
武田的维布妥昔单抗(Brentuximab vedotin,Adcetris)
Adcetris:CD30 靶点本妥昔单抗+微管抑制剂 MMAE+二肽连接子,随机偶联而成。Padcev:Nectin4 靶点 AGS-22C3 抗体+ MMAE+二肽连接子,半胱氨酸残基定点偶联。
维布妥昔单抗(Adcetris)是西雅图遗传学公司开发的一款ADC,由CD30靶向的单克隆抗体Brentuximab、微管破坏剂MMAE和一种蛋白酶敏感的交联剂组成。通过连接物MMAE被共价地附着至抗体。
非临床资料提示ADCETRIS的抗癌活性是由于ADC结合至CD30-表达细胞,接着ADC-CD30复合物内化,和通过蛋白水解裂解释放MMAE。在细胞内MMAE结合至微管破坏微管网络,随后引起细胞周期停止和细胞的凋亡。
Adcetris 是 Seagen 公司第一个上市的药物,也是全球第二款上市的 ADC 药物,于 2011 年获批治疗淋巴瘤,截止 2021 年底,已在全球 76 个国家上市。
2009年武田获得该药在美国和加拿大之外全球其他国家和地区的商业化权利。该药最早于2011年8月在美国获批,目前已在全球获批多种适应症,包括霍奇金淋巴瘤、原发性皮肤间变性大细胞淋巴瘤、系统性间变性大细胞淋巴瘤、蕈样肉芽肿、血管免疫母细胞性T细胞淋巴瘤和外周T细胞淋巴瘤等。
生物技术公司Seagen和武田将在ASCO 2022年会上公布Adcetris有望成为新的淋巴瘤组合药物。最新数据显示,在未接受治疗的III/IV期霍奇金淋巴瘤患者进行的3期Echelon-1研究中,接受Adcetris联合治疗,在次要指标(总体生存率)方面优于标准疗法ABVD组合。在长达六年的中位随访中,与标准疗法相比,接受Adcetris治疗的患者死亡风险降低了41%。在一项包括1334名患者的试验中,Adcetris组有39人死亡,而ABVD组有64人死亡。此外,Adcetris组合疗法的安全性与之前的研究一致。(动脉网)
网络资料显示,日本武田制药生产的本妥昔单抗(Adcetris),50mg一支,12500元左右(由于汇率浮动价格不能固定)。
辉瑞的「奥加伊妥珠单抗」
辉瑞(Pfizer)公司申请的注射用奥加伊妥珠单抗(曾用名:注射用伊珠单抗奥唑米星),由 CD22 靶向单抗 inotuzumab 与细胞毒制剂卡奇霉素偶联而成,适应症为成人复发或难治性前体 B 细胞急性淋巴细胞性白血病。
Besponsa(奥加伊妥珠单抗)是一种靶向CD22的抗体-药物偶联物(ADC)。奥英妥珠单抗可识别人CD22。小分子N-乙酰基-γ-卡奇霉素是通过接头与抗体共价连接的细胞毒性剂。
非临床资料表明,Besponsa的抗癌活性是由于ADC与CD22表达肿瘤细胞的结合,随后ADC-CD22复合物内化,N-乙酰基-γ-卡奇霉素二甲酰肼共价键水解断裂。N-乙酰基-γ-卡奇霉素二甲基酰肼的活化诱导双链DNA断裂,随后诱导细胞周期停滞和细胞凋亡。
2017年8月,奥加伊妥珠单抗获得美国FDA批准,治疗成人复发或难治性B细胞前体急性淋巴性白血病。值得一提的是,这是首款获得FDA批准的靶向CD22的抗体偶联药物。
根据奥加伊妥珠单抗在美国获批这一适应症时的临床数据,在治疗成人复发或难治性B细胞前体急性淋巴性白血病中,与化疗组相比,奥加伊妥珠单抗组能够显著提高患者的完全缓解率(CR),并延长了患者的中位总生存期。
奥加伊妥珠单抗的国内上市申请,于2020年1月获得中国国家药监局药品审评中心(CDE)受理,并因“具有明显治疗优势创新药”被纳入优先审评。
网络未收集到奥加伊妥珠单抗在国内的销售价格信息。其在国外的参考售价21,347美元,折合人民币大约是120000/瓶,根据汇率的波动价格会有所调整。
荣昌生物的维迪西妥单抗
维迪西妥单抗(RC48,爱地希)是荣昌生物自主研发的 HER2 ADC药物,由靶向 HER2的人源化单抗、可裂解多肽 Mc-VC-PAB 连接子和细胞毒素 MMAE 组合而成,偶联方式为半胱氨酸随机偶联,平均 DAR 为 4。
维迪西妥单抗的通过利用 HER2抗体 将细胞毒药物 MMAE 特异性递送到目标肿瘤细胞内,从而导致肿瘤细胞死亡,具体过程包括:
1)维迪西妥单抗的抗体部分 结合至肿瘤表面的 HER2 胞外结构域;
2)在受体介导的内吞作用下,维迪西妥单抗被转运到溶酶体;
3)连接子被酶剪切 后,MMAE 细胞毒被释放到细胞内,从而破坏细胞内微管网络,致使细胞凋亡。
维迪西妥单抗设计
1)抗体端:拥有自主知识产权的高 HER2亲和力新型人源化抗体,具体靶向的 HER2受体上的表位存在不同,具有更强的 亲和力和更高效的细胞内吞效应,因此相比 Kadcyla 使用的曲妥珠单抗具有更强的 HER2 亲和力。
2)连接子:具有胞内酶解特性,与 Kadcyla 使用的不可裂解连接子相比,维迪西妥单抗可实现在肿瘤细胞内精准释放高毒 性的细胞毒素,降低对脱靶毒性。此外,胃癌细胞溶酶体中 V-ATPase可能导致不可裂解连接子难以降解,因此对 Kadcyla 具有耐药性,而可裂解连接子的降解过程对 V-ATPase 活性的依赖较小,因此维迪西妥单抗有望克服这种耐药。
3)细胞毒素:具有高膜穿透效应,通过细胞毒素的胞内裂解及扩散对周围肿瘤细胞具有较强的“旁杀效应”,因此其肿瘤细 胞清除能力相比 Kadcyla 更强。
小白学药GONG ZHONG HAO
第一三共/阿斯利康的 Enhertu
目前已经在国内上市的 HER2 ADC药物为 Roche的 Kadcyla和公司的维迪西妥单抗,此外,第一三共的 Enhertu 也已提交上市申请。
2022年3月21日,第一三共的新药Trastuzumab Deruxtecan(DS-8201)的上市申请获得NMPA受理。
2019年03月28日,阿斯利康宣布第一三共达成协议,在全球范围内合作开发DS-8201,首付款13.5亿美元,里程碑金55.5亿美元,总金额高达69亿美元!
DS-8201商品名为Enhertu,靶点为HER2,可裂解连接子,细胞毒药物为拓扑异构酶1抑制剂。
DS-8201于2019年12月在获得乳腺癌适应症,用于治疗三线治疗经治HER2阳性无法切除或转移性HER2阳性乳腺癌患者。
2022年V1版NCCN指南已将DS-8201列为HER2阳性、复发不可切除或IV期乳腺癌二线治疗的首选方案。
DS-8201适应症还包括局部晚期或转移性的HER2阳性胃或胃食管腺癌,HER2突变型转移性非小细胞肺癌,以及治疗HER2阳性的结直肠癌。其临床试验数据,相比于化疗,DS-8201显著延长了HER2低表达乳腺癌患者的无进展生存期和总生存期,有望改变HER2低表达乳腺癌的治疗格局。
我国ADC药物研发起步虽晚,但研发热情高涨。在目前全球公布的400个ADC在研候选药物中,中国企业在研的ADC候选物占据144个。部分业内人士认为,国内ADC药物市场仍有较大发展空间。