恒瑞医药:SHR-1316 注射液、SHR-1704 注射液(联合用于清除肿瘤细胞)获批临床
步长制药:WXSH0024原料/胶囊(用于神经病理性疼痛)获批临床
景峰医药:心脑宁胶囊(治疗气滞血瘀的胸痹,头痛,眩晕等)获再次注册批件
易明医药: 多潘立酮片(治疗恶心和呕吐)通过一致性评价
复星医药:苯磺酸氨氯地平片(治疗高血压、冠心病)通过一致性评价
迈克生物:3项新产品获产品注册证书
众生药业:控股子公司获韩国专利证书
博腾股份:收到《欧盟GMP证书》
长春高新:重组上会,股票停牌(拟作价56.37购买金赛药业29.5%股权)
振德医疗:公开发行可转债获批
普利制药:非公开发行股票获批;为全资子公司提供1亿元的综合授信担保
润达医疗:发行A股可转债收到证监会行政许可项目审查一次反馈意见通知书
恩华药业:拟转让控股子公司南京恩华和润至少51%的股权(转让前控股80%)于南京医药(转让后不再合并报表,但因恩华和润主要从事药品批发业务,剥离后公司聚焦主业务,2018年恩化和润净利润约945万占总利润2%不到,预计对2019年业绩影响不大。相当于剥离拖累型业务,聚焦主业发展,可以理解为利好)
辽宁成大:第一期短期融资券(10亿元)到期
昭衍新药:拟向激励对象授予112.4万份股票期权,40.5万股限制性股票
延安必康:股东及其一致行动人减持比例达到7%
桂林三金:已累计回购1.5亿股,占总股本的2.53%,回购实施完毕
九州通:累计回购1.96亿股,回购比例达到1%
楚天科技:控股股东增持计划完成,占总股本的0.51%
上海医药:控股股东及一致行动人增持H股174.31万股
通策医疗:财务总监叶飞辞职
每日医药资讯时间确定!医械身份证马上下发 最严监管来了:
近期,据国家药监局官网消息,医疗器械唯一标识系统试点工作步入实质阶段。国家药品监管局副局长徐景和指出,建立UDI制度,强化源头赋码,实现从源头生产到临床使用全链条医疗器械通查通识。
镰状细胞贫血症创新疗法获得优先审评资格 有望获得加速批准:
日前,Global Blood Therapeutics公司宣布,美国FDA已经接受该公司为口服镰状细胞贫血症疗法voxelotor的新药申请。同时,FDA授予这一申请优先审评资格,预计将在明年2月26日前作出回复。如果获得批准,voxelotor将成为靶向血红蛋白聚合过程的首款获批疗法。值得注意的是,FDA将使用加速批准通路对voxelotor进行审评,这意味着voxelotor可以依靠替代终点的表现获得批准。
诺华眼科药物Lucentis在欧盟获批第7个适应症:
诺华眼科药物雷珠单抗近日在欧盟监管方面传来喜讯。欧盟委员会的(EC)已批准Lucentis(10mg/mL)用于治疗早产儿视网膜病变(ROP),这是一种罕见的眼病,也是导致儿童失明的主要原因。值得一提的是,Lucentis是欧盟批准的第一种也是唯一一个治疗ROP的药物,该药将适用于早产儿I区、II区、急进性后部型ROP的治疗。
大鹏制药Lonsurf获中国批准 治疗转移性结直肠癌:
日本药企大鹏制药近日宣布,国家药监局已批准抗癌药Lonsurf,用于先前已接受过氟尿嘧啶、奥沙利铂或伊立替康为基础的化疗、以及可能接受过或无法接受抗VEGF生物制剂和(若RAS野生型)抗EGFR疗法制剂的转移性结直肠癌(mCRC)患者的治疗。
FDA授予Magenta公司MGTA-456再生医学先进疗法资格:
Magenta Therapeutics是一家临床阶段的生物技术公司,致力于开发创新药物用于自身免疫性疾病、血液癌症和遗传性疾病的治疗。近日,该公司宣布,美国食品和药物管理局(FDA)已授予一次性细胞疗法MGTA-456治疗多种遗传性代谢紊乱疾病的再生医学先进疗法资格(RMAT)。
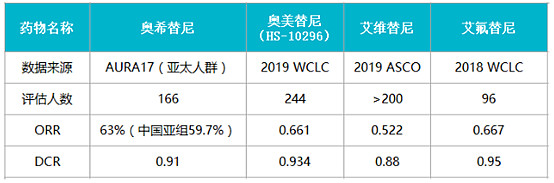
豪森三代 EGFR-TKI 临床再传喜讯 奥希替尼市场独占或被撼动:
9月7日,2019年世界肺癌大会(World Conference on Lung Cancer,WCLC)在西班牙巴塞罗那召开。会议期间,豪森公布了其旗下新型一类国产三代 EGFR 抑制剂「奥美替尼(HS-10296)」的最新临床结果,受到了较大的关注。
豪森「奥美替尼」临床新进展该临床研究在 2018 年 5 月 16 日至 2018 年 10 月 23 日期间共招募了 244 名患者(中位年龄 60.8 岁),包括中国大陆 189 名患者和台湾 55 名患者,其中两名患者未达到评估标准而被排除。同竞争品临床数据对比如下:
Imfinzi+化疗一线治疗小细胞肺癌III期数据公布:显著延长OS,死亡风险降低27%:
9月9日,阿斯利康在WCLC2019大会上公布了Imfinzi联合化疗用于既往未接受过治疗的广泛期小细胞肺癌(SCLC)患者的Ⅲ期CASPIAN研究总生存期(OS)数据。
这项代号为CASPIAN的随机、开放标签、全球多中心的Ⅲ期临床试验,旨在评估Imfinzi联合标准化疗(依托泊苷+顺铂/卡铂)、Imfinzi + tremelimumab+化疗较相比单独使用化疗的疗效和安全性。其中试验组患者最多接受4个周期的化疗,而对照组患者则允许接受6个周期的化疗和预防性脑照射(PCI)。
结果显示, Imfinzi+化疗较标准治疗将SCLC患者死亡风险降低了27%,中位OS显著延长(13.0 vs 10.3个月),到达主要终点。接受Imfinzi+化疗和标准治疗18个月的两组患者依然存活的比例分别33.9%和24.7%。另外,Imfinzi+化疗较标准治疗12个月PFS显著延长(17.5% vs 4.7%),ORR增加10.3%(67.9% vs 57.6%)。