一种针对 SARS-CoV-2 刺突蛋白 furin 酶切位点的新型抗体:对蛋白水解切割和 ACE2 结合的影响
没插图修理,全文7400字呢。 过几天来把这篇完善了,先看个大概。
A novel antibody against the furin cleavage site of SARS-CoV-2 spike
protein: Effects on proteolytic cleavage and ACE2 binding
SARS-CoV-2 在其刺突蛋白中具有一个独特的 S1/S2 furin 酶切位点,该位点可以被 furin 和其他前蛋白转化酶切割。SARS-CoV-2 刺突蛋白在 S1/S2 边界的蛋白水解激活有助于其与宿主 ACE2 受体的相互作用,从而进入细胞。为了解决这个问题,研究人员针对 SARS-CoV-2 特异性的 furin 模体生成了高滴度抗体。通过一系列创新的基于 ELISA 的检测,这种 furin 位点阻断抗体显示出对 S1/S2 furin 酶切位点(包括带有 P681R 突变的位点)的高敏感性和特异性,并能有效阻止酶介导的切割和刺突蛋白与 ACE2 的相互作用。结果表明,免疫阻断 furin 酶切位点可能是抑制 SARS-CoV-2 刺突蛋白蛋白水解激活和减少病毒感染性的合适方法。
引言
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)首次在2020年初被发现,是当前COVID-19大流行的罪魁祸首【1】。SARS-CoV-2由一个正链单链RNA基因组和4种不同类型的结构蛋白组成【2】。N蛋白(核衣壳蛋白)包裹着基因组,而S(刺突)、E(包膜)和M(膜)蛋白则组成了周围的脂双层包膜。特别值得关注的是S蛋白,它通过识别血管紧张素转换酶2(ACE2)受体并进行膜融合,从而实现病毒感染,这使得该结构蛋白成为治疗干预的理想目标。
S蛋白由两个亚基S1和S2组成。S1亚基中有一个受体结合域(RBD),它识别并结合ACE2受体【3】。S蛋白在两个亚基的边界处还具有一个furin酶切位点【4】。完整的SARS-CoV-2 furin酶切位点已被表征为对应于SARS-CoV-2刺突蛋白A672-S691氨基酸序列的20个氨基酸基序(图1),其中一个核心区域SPRRAR|SV(8个氨基酸,S680-V687)和两个侧翼的溶剂可及区域(8个氨基酸,A672-N679和4个氨基酸,A688-S691)【5,6】。核心区域非常独特,因为其R683和A684位置分别是带正电荷的(精氨酸)和疏水性的(丙氨酸)残基,这些位置可被来自宿主细胞和呼吸道上皮细胞的细菌分泌的前蛋白转化酶(PC)furin或furin样PCs切割【7】。将R683位点突变为Q683是当前基于蛋白质的疫苗候选物中包含的几种关键修饰之一,这通过使其对蛋白酶具有抗性来稳定S蛋白抗原的融合前形式【8,9】。在Delta变体中观察到p681位点突变为R681,并显示出更高的感染和传播能力【10】。有趣的是,一个核心区域中所有精氨酸被排除的缺失变体尽管潜在地失去了furin切割的易感性,但并未影响体外病毒复制【11】。
furin和furin样PCs(如PC5/6A和PACE4)被证明是特定于切割区域序列的,这些PCs在组织中广泛分布【12】。由于这种独特的furin酶切位点,这种分布可能解释了COVID-19为何会对多器官造成损害。因此,阻断由furin或促进蛋白酶活性引起的SARS-CoV-2 S1/S2位点切割的重要性在于,已记录的S蛋白在S1/S2位点的切割对于SARS-CoV-2结合宿主ACE2受体、细胞-细胞融合以及感染人类肺细胞是必不可少的【13,14】。
鉴于PC介导的切割与S蛋白激活之间的关联,我们假设阻断furin酶切位点可能通过阻碍酶的作用和S蛋白-ACE2相互作用来潜在地阻止SARS-CoV-2感染。为了解决这个问题,我们生成了一种对SARS-CoV-2刺突蛋白furin酶切位点具有高敏感性和特异性的创新抗体。然后在一系列创新的体外检测中使用这种抗体,观察到它能有效阻止a)纯化的酶和人类样本的切割,b)与ACE2的结合。据我们所知,这是首次建立针对SARS-CoV-2特定PC活性靶标的抗体策略。
材料与方法
2.1. furin位点阻断抗体(fbAB)的生成
抗原由与钥孔杯同源血蓝蛋白(KLH)结合的SARS-CoV-2特异性furin基序(20个氨基酸;图1)组成。将0.5 mg的多肽-KLH结合物与弗氏佐剂一起注射到新西兰白兔体内,并在2周内进行3次(每次0.25 mg)的加强注射。加强注射后1周收集血清,并使用SulfoLink蛋白A柱(ThermoFisher Scientific)纯化抗体。
2.2. fbAB滴度的定量
为了测试生成的fbAB的滴度,将抗原以200 ng/孔的浓度(使用0.1 M NaCO3)包被在高蛋白结合性聚苯乙烯8孔微量滴定板条(Greiner)上。将条带在37°C下孵育2小时进行包被,然后用2% BSA(在PBS中)在37°C下阻断1小时。用含有0.1% Tween 20的PBS(PBS-T)洗涤条带3次后,将fbAB以指定稀释度(使用PBS-T制备)加入孔中,并在室温下孵育1小时。洗涤4次后,加入50 µl抗兔IgG-HRP(EpiGentek)(1:2000稀释在PBS-T中),并在室温下孵育30分钟。再洗涤4次后,每孔加入100 µl TMB溶液(EMD Millipore Corp.),并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器(MRX-TC Revelation, Dynex Technologies)在450 nm波长下测量光密度。
2.3. fbAB识别的敏感性
加入含有S1/S2边界furin位点并在N端标记有多组氨酸(His)的SARS-CoV-2蛋白(Sino Biological),浓度范围为0.01 - 100 ng/孔(使用PBS制备),加入到已阻断(2% BSA)的镍-硝基三乙酸(Ni-NTA)涂层的聚苯乙烯8孔微量滴定板条(Fisher)中,并在室温下孵育45分钟。用PBS-T洗涤条带2次后,加入50 µl fbAB(1:2000稀释在PBS-T中),并在室温下孵育1小时。再洗涤3次后,加入50 µl抗兔IgG-HRP(1:2000稀释在PBS-T中),并在室温下孵育30分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.4. fbAB识别的特异性
将含有S1/S2边界furin位点的His标记SARS-CoV-2蛋白、含有野生型、突变型(P681R和R683Q)和三重R缺失的SARS-CoV-2特异性furin基序(EpiGentek)的His标记多肽,以及缺乏S1/S2边界furin位点的His标记SARS-CoV-2 S1 RBD蛋白(EpiGentek),以10 ng/孔的浓度(使用PBS制备)加入到已阻断(2% BSA)的Ni-NTA涂层条带中,并在37°C下孵育1小时。用PBS-T洗涤条带2次后,加入50 µl fbAB(1:5000稀释在PBS-T中),并在室温下孵育1小时。再洗涤3次后,加入50 µl抗兔IgG-HRP(1:2000稀释在PBS-T中),并在室温下孵育30分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.5. fbAB的免疫沉淀
将fbAB以200 ng/孔的浓度(使用0.1 M NaCO3)包被在8孔聚苯乙烯微量滴定板条上。将条带在37°C下孵育2小时进行包被,用PBS-T洗涤3次后,再用2% BSA(在PBS中)在37°C下阻断1小时。洗涤条带3次后,将含有S1/S2边界furin位点的His标记SARS-CoV-2蛋白或含有SARS-CoV-2特异性furin基序的His标记多肽以不同浓度(使用PBS制备)加入到fbAB包被的孔中,并在室温下孵育2小时。洗涤3次后,加入Ni-NTA-HRP(Millipore)(50 µl,1:4000稀释在PBS-T中),在室温下孵育30分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.6. fbAB阻断furin介导的切割
含有野生型、突变型(P681R和R683Q)和三重R缺失的SARS-CoV-2特异性furin基序并在N端和C端分别标记有His和生物素的多肽(EpiGentek),以10 ng/孔的浓度(使用PBS制备)加入到已阻断(2% BSA)的Ni-NTA涂层条带中,并在室温下孵育1小时。用PBS-T洗涤条带3次后,加入200 ng/孔的fbAB(使用PBS-T制备),并在37°C下孵育1小时。以靶向刺突RBD的SARS-CoV-2中和抗体(EpiGentek)作为对照。洗涤3次后,加入不同浓度(8-16 ng/孔)的纯化前蛋白转化酶furin(New England Biolabs),并在37°C下孵育25分钟。使用蛋白酶切割(PC)检测缓冲液(EpiGentek)制备furin溶液。洗涤4次后,加入链霉亲和素-HRP(100 µl,1:5000稀释在PBS-T中),在室温下孵育15分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.7. fbAB阻断胰蛋白酶介导的切割
将含有野生型、突变型(P681R和R683Q)和三重R缺失的SARS-CoV-2特异性furin基序并标记有His和生物素的多肽以10 ng/孔的浓度(使用PBS制备)加入到已阻断(2% BSA)的Ni-NTA涂层的8孔微量滴定板中,并在室温下孵育1小时。用PBS-T洗涤条带3次后,加入200 ng/孔的fbAB(使用PBS-T制备),并在37°C下孵育1小时。洗涤3次后,加入20 ng/孔的丝氨酸蛋白酶胰蛋白酶(Sigma)(使用PC检测缓冲液制备),并在37°C下孵育25分钟。再洗涤4次后,加入链霉亲和素-HRP(100 µl,1:5000稀释在PBS-T中),在室温下孵育15分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.8. fbAB阻断人类鼻拭子介导的切割
根据CDC标准鼻拭子采集协议,从健康未感染的志愿者处采集鼻拭子样本。将收集的样本通过在PC检测缓冲液中旋转30秒释放到300 µl的缓冲液中。
将含有SARS-CoV-2特异性furin基序并标记有His和生物素的多肽以10 ng/孔的浓度(使用PBS制备)加入到已阻断(2% BSA)的Ni-NTA涂层的8孔微量滴定板中,并在室温下孵育1小时。用PBS-T洗涤条带3次后,加入200 ng/孔的fbAB(使用PBS-T制备),并在37°C下孵育1小时。洗涤3次后,每孔加入20-30 µl的鼻拭子样本溶液,并在37°C下孵育25分钟。再洗涤4次后,加入链霉亲和素-HRP(100 µl,1:5000稀释在PBS-T中),在室温下孵育15分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.9. fbAB阻断刺突-ACE2结合
将含有S1/S2边界furin位点的未标记SARS-CoV-2刺突蛋白(GenScript)以50 ng/孔的浓度(使用0.1 M NaCO3)包被在高蛋白结合性聚苯乙烯8孔微量滴定板上。将条带在37°C下孵育2小时进行包被,然后用2% BSA(在PBS中)在37°C下阻断1小时。用PBS-T洗涤条带3次后,将fbAB以指定浓度(使用PBS-T制备)加入孔中,并在37°C下孵育1小时。洗涤3次后,加入100 ng/孔的纯化His标记ACE2(EpiGentek)(使用PBS制备),并在37°C下孵育1小时。再洗涤3次后,加入Ni-NTA-HRP(50 µl,1:4000稀释在PBS-T中),在室温下孵育30分钟。再洗涤4次后,每孔加入100 µl TMB溶液,并监测蓝色颜色发展2-10分钟。反应用等体积的1 M HCl停止,并使用微量滴定板读数器在450 nm波长下测量光密度。
2.10. 统计分析
数据以均值 ± 标准误差(SEM)表示,来自2个独立重复实验。均值之间的差异通过双尾t检验进行分析。
酶处理样品在有或无fbAB孵育条件下的切割百分比计算如下:

刺突蛋白在不同浓度的fbAB孵育条件下的ACE2结合活性百分比计算如下:
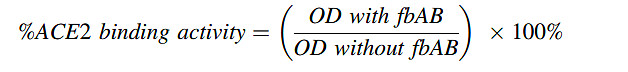
3. 结果
在针对包含20个氨基酸的SARS-CoV-2特异性弗林酶(furin)基序(图1)抗原生成了弗林酶位点阻断抗体(fbAB)之后,使用基于ELISA的比色检测系统对fbAB的效价进行了评估。在图2中显示,与正常血清相比,从抗原注射宿主血清中纯化的fbAB在8000倍稀释时显示出强信号强度(OD >2.5)。光密度在连续2倍系列稀释中线性下降,但在128000倍稀释时仍观察到高信号强度(OD >1)。结果表明,从抗原注射的宿主中可以生成大量针对SARS-CoV-2刺突蛋白的弗林酶基序的fbAB,并可以通过这种新颖的比色测定法进行检测。
通过在镍涂层微孔板孔中孵育不同量的His标签目标蛋白,确定fbAB识别SARS-CoV-2刺突蛋白S1/S2边界弗林酶位点的灵敏度。然后使用基于ELISA的检测比色法测量fbAB捕获孔中结合的目标蛋白。如图3所示,目标蛋白显示出剂量反应,信号强度线性增加,最高可达100 ng/孔的浓度。在该测定中检测到最低为0.05 ng/孔的蛋白,表明fbAB对SARS-CoV-2特异性弗林酶基序的识别具有高灵敏度。
通过在涂有以下物质的孔中孵育抗体,评估fbAB与刺突蛋白相互作用的特异性:包含S1/S2边界弗林酶位点的SARS-CoV-2刺突蛋白;包含野生型、突变型(P681R和R683Q)和三重R缺失的SARS-CoV-2特异性弗林酶基序的肽;或SARS-CoV-2 S1 RBD蛋白。如图4所示,fbAB显示出与野生型弗林酶切割位点的刺突蛋白和肽的强结合相互作用。缺乏S1/S2边界弗林酶位点的SARS-CoV-2 S1 RBD蛋白未引起可检测的信号。抗体结合亲和力测试表明,核心弗林酶切割区域的突变和缺失仅导致轻微的结合亲和力下降(补充图S1)。P681R突变、R683Q突变和三重R缺失的结合常数(KD)分别为1.1 nM、1.8 nM和1.5 nM,而野生型为1.0 nM。因此,该相互作用对野生型和突变/缺失肽均高度特异。
由于核心区域的修饰并未显著影响fbAB的结合,我们进一步研究了SARS-CoV-2弗林酶切割位点的溶剂可接近部分在fbAB结合中的作用。通过胰蛋白酶切割去除C末端部分(P4-P6')或N末端部分(P14-P1),然后确定fbAB抗体结合情况。结果显示,N末端溶剂可接近区域的肽允许抗体结合达到野生型肽结合的71%(补充图S2)。C末端溶剂可接近区域的肽抗体结合约为野生型肽结合的57%。这些结果表明,SARS-CoV-2弗林酶切割位点的溶剂可接近部分对fbAB的结合至关重要。
刺突蛋白和肽进一步用于评估fbAB在抗体涂层孔中的免疫沉淀效率。图5显示,fbAB以浓度依赖的方式有效免疫捕获刺突蛋白和肽。结果表明,合成肽与生物学S蛋白作为测定基质相同,因为合成肽和全长S蛋白都被fbAB强结合。因此,在后续的切割阻断测定中使用了合成肽。
接下来,研究了通过酶活性阻断SARS-CoV-2弗林酶基序切割的fbAB。含有SARS-CoV-2特异性弗林酶基序的双His和生物素标记肽被结合到镍涂层微孔板孔中。然后将这些孔孵育在fbAB中,随后暴露于两种不同的酶(弗林酶,胰蛋白酶)或人类鼻拭子样本中。在弗林酶基序处的切割将移除肽的C末端部分,导致生物素-辣根过氧化物酶(HRP)结合减少,信号强度降低。如图6A所示,fbAB有效阻止了纯化弗林酶酶(8 ng/孔)对野生型和P681R SARS-CoV-2弗林酶基序的切割。在较高浓度(16 ng/孔)下,弗林酶酶增加了对野生型和P681R SARS-CoV-2弗林酶切割位点的切割,fbAB在该浓度下也有效减少了弗林酶的切割(图6B)。肽在结合测定孔之前预先与fbAB孵育同样可以防止弗林酶的切割(补充图S3)。作为对照的SARS-CoV-2中和抗体(SnAB),其靶向刺突RBD,显示出最小的弗林酶介导的切割阻断(图6A)。fbAB还下调了由胰蛋白酶介导的切割(图7),尽管与弗林酶相比程度较小。人类鼻拭子样本中的PC显示出高切割百分比(约80%),在fbAB存在下减少了约20-26%(图8)。
由于S蛋白在S1/S2位点的切割是SARS-CoV-2与宿主ACE2受体结合并进入细胞所必需的,我们测试了fbAB对SARS-CoV-2刺突蛋白包被孔中刺突-ACE2相互作用的影响。如图9所示,fbAB以剂量依赖的方式阻断了ACE2与S蛋白的结合,在40 nM的fbAB剂量下,ACE2结合活性降低了超过60%,在80 nM抗体下几乎完全抑制了刺突-ACE2的结合。
4. 讨论
在感染过程中,SARS-CoV-2 的细胞进入机制涉及与宿主 ACE2 受体的直接接触,这一过程由 S 蛋白 S1 亚基中的受体结合域(RBD)介导,同时需要细胞表面跨膜丝氨酸蛋白酶 2(TMPRSS2)和细胞内的组织蛋白酶 L 对 S1/S2 多碱性切割位点的蛋白水解切割【2,14,15】。S1/S2 接合处还具有一个独特的弗林酶(furin)切割位点,该位点可以被弗林酶和其他前蛋白转化酶(PCs)切割,这可能增强感染力【13,16】。最近的一项研究表明,删除弗林酶切割位点的 SARS-CoV-2 突变体在人体呼吸道细胞中的复制减少,并在体内模型中表现出病毒致病性减弱【17】。相反,P681H(Alpha 变种)和 P681R(Delta 变种)的突变显著增加了病毒的复制和传播【10,18】,这主要是由于弗林酶酶对 S1/S2 位点的切割增加【19】。由于弗林酶的广泛表达,尤其是在人体肺部【20,21】,使其成为治疗干预的理想目标。
通过使用包含 SARS-CoV-2 特异性弗林酶切割序列(完整 20 个氨基酸基序,图 1)的合成肽作为抗原,产生了高效价抗体,该抗体对 S1/S2 边界弗林酶位点具有高灵敏度和特异性。进一步使用一系列创新的基于 ELISA 的比色测定法,快速且可靠地测量了其阻断切割和受体相互作用的效率。fbAB 有效阻止了纯化弗林酶酶、丝氨酸蛋白酶胰蛋白酶和人类鼻拭子样本对 SARS-CoV-2 野生型和/或 P681R S1/S2 弗林酶位点的切割。在无症状和有症状的 COVID-19 患者中,鼻样本显示出比喉咙样本更高的病毒载量【22】,这表明鼻上皮是初始感染和传播的门户,也是通过鼻腔中来自宿主和细菌的 PC 预活化进行病毒复制的主要位置。根据我们的结果,人类鼻拭子样本显示了测定基质中 SARS-CoV-2 特异性弗林酶基序的 80% 切割,确认了这种样本类型是丰富 PC 活性的有效生物来源。
将非极性的脯氨酸 P681 突变为带正电荷的精氨酸 R681 以形成多碱性氨基酸位点,进一步增加了 S1/S2 边界切割,从而增加了人类呼吸道中的病毒复制和传播【10】。P681R 突变是 Delta 变种的标志,该变种是 COVID-19 全球大流行的主要毒株,并导致 SARS-CoV-2 对野生型刺突疫苗的抗性增加【23】。因此,抑制含有 P681R 的 SARS-CoV-2 弗林酶位点的切割,可以减少基于弗林酶位点切割的 SARS-CoV-2 Delta 变种刺突蛋白的活化,从而减少病毒与 ACE2 的结合、细胞-细胞融合和病毒进入人类细胞。根据我们的结果,包含 P681R 突变 SARS-CoV-2 特异性弗林酶基序的肽确实比野生型位点更易被弗林酶切割,且 fbAB 处理显著减少了切割百分比。
需要注意的是,除了阻止结合的目标蛋白的弗林酶介导切割外,在固定于孔表面之前,fbAB 与含有 SARS-CoV-2 特异性弗林酶基序的肽预孵育也有效抑制了酶切割。由于病毒颗粒在全身循环中是移动的目标,有必要确认抗体与悬浮状态的未结合目标相互作用可以减少切割产物的形成,如同固定肽一样。
鉴于刺突/弗林酶/ACE2 信号轴在 SARS-CoV-2 感染途径中的重要性,fbAB 破坏 S 蛋白与宿主受体结合相互作用的能力对减缓疾病传播至关重要。fbAB 显示出非常高的效力,在 S 蛋白包被的微孔板孔中阻断 ACE2 的结合,以亚微摩尔浓度的抗体有效减少受体结合活性到几乎不可检测的水平。
目前阻断或减少目标蛋白弗林酶位点切割的方法主要依赖于直接抑制弗林酶或类似弗林酶的酶。通常通过天然存在的大分子蛋白质抑制剂(如 serpin A1-抗胰蛋白酶)或小分子化学抑制剂(如纯肽、肽模拟物和非肽类化合物)实现这种抑制。由于这些抑制剂选择性针对蛋白酶本身,而不是特定的蛋白水解活性位点,它们在防止特定位置(如 SARS-CoV-2 S 蛋白)的弗林酶位点切割方面的抑制效果有限。此外,弗林酶和相关的前蛋白转化酶广泛分布于各种人体组织中,抑制宿主蛋白酶可能会非特异性地损害这些酶所需激活的蛋白质的正常功能。因此,我们实施抗体阻止 SARS-CoV-2 特异性弗林酶位点被弗林酶和促成蛋白酶切割的策略,将是控制 SARS-CoV-2 刺突蛋白活化和病毒传播的选择性方案。