一个经鼻输送的流感病毒载体疫苗可以预防小鼠和仓鼠呼吸道组织中的SARS-CoV-2复制。
An intranasal influenza virus-vectored vaccine prevents SARS-CoV-2 replication in respiratory tissues of mice and hamsters
doi.org/10.1038/s41467-023-37697-1
Received: 21 July 2022
Accepted: 23 March 2023
Published online 12 April 2023
目前可用的COVID-19疫苗在减少由SARS-CoV-2感染引起的严重疾病和死亡方面有效,但在预防感染方面不够理想。迫切需要能够诱导上呼吸道黏膜免疫以预防或减少由高传播力变异株SARS-CoV-2引起的感染的下一代疫苗。我们开发了一种基于缺失NS1基因的活病毒衰减流感病毒(LAIV)的经鼻疫苗候选疫苗,该基因编码SARS-CoV-2刺突蛋白受体结合结构域(RBD)的细胞表面表达,称为DelNS1-RBD4N-DAF。通过对小鼠和仓鼠进行DelNS1-RBD4N-DAF疫苗经鼻给药后的免疫应答和对攻毒试验的保护进行分析,并与BioNTech BNT162b2 mRNA疫苗的肌肉注射进行比较。DelNS1-RBD4N-DAF LAIV在小鼠和仓鼠中诱导了高水平的中和抗体,针对不同的SARS-CoV-2变异株,并在小鼠中刺激了强有力的T细胞应答。值得注意的是,接种DelNS1-RBD4N-DAF LAIV,但不是BNT162b2 mRNA,可以预防动物呼吸道组织中的SARS-CoV-2变异株复制,包括Delta和Omicron BA.2。DelNS1-RBD4N-DAF LAIV系统需要进一步在人体中进行评估,以控制SARS-CoV-2的传播,更重要的是,用于年度疫苗接种策略中的流感和COVID-19的双重功能疫苗的创建。
2019年末SARS-CoV-2在人类中的出现导致了COVID-19大流行,对人类健康、社会稳定和经济产生了前所未有的全球影响。迅速开发和部署了几种用于紧急使用的疫苗显著缓解了由SARS-CoV-2感染引起的COVID-19疾病。然而,SARS-CoV-2在人类中的持续流行导致了高传播性的VoC 关注变异株的出现,这些变异株具有免疫逃逸能力,对结束COVID-19大流行的努力构成了相当大的病毒暴露。尽管变异株表现出不同的致病特性,最近的奥密克戎变异主要引起轻度疾病,但高传播率和由于免疫逃逸导致的再感染仍可能导致大量的住院和死亡,尤其是在老年人中。目前的mRNA、灭活全病毒颗粒和腺病毒载体疫苗是肌肉注射的,并能够在人体内诱导显著水平的血清抗体和流行T细胞应答,有助于预防严重的COVID-19疾病或死亡。目前COVID-19疫苗在上呼吸道诱导的免疫水平和范围尚不清楚,而SARS-CoV-2感染正是在这里开始的。疫苗接种者普遍出现的突破感染以及一些个体的重复感染提示(新冠肺炎存在解剖学逃逸的特性),可能需要采取增强上呼吸道免疫的替代疫苗方法。增强疫苗诱导的上呼吸道免疫是下一阶段疫苗开发的关键焦点,以将SARS-CoV-2流行降低到较低水平。事实上,几种经鼻给药的疫苗候选疫苗已经显示出明显优势,能够诱导黏膜免疫并阻断病毒在气道中的复制。SARS-CoV-2很可能会继续与季节性流感共同流行,引起年度流行病。一种预防COVID和流感的双重功能疫苗可能更受到普通大众的接受,并且在大流行后控制流行病可能更具成本效益。
我们先前报道了一系列活性减弱的流感病毒(LAIV),其中NS1基因从病毒基因组中删除(DelNS1),并且适应性突变支持病毒在受精鸡蛋和MDCK细胞中的复制。我们已经展示了使用DelNS1 LAIV进行免疫可以在流感感染模型中提供交叉保护,并可能提供长期免疫。我们进一步发展了DelNS1 LAIV系统,将SARS-CoV-2的受体结合结构域(RBD)插入到NS1删除位点,并显示DelNS1-RBD LAIV二针法在小鼠模型中诱导了强有力的系统和黏膜免疫应答,以阻断SARS-CoV-2感染。使用疫苗候选疫苗DelNS1-nCoV-RBD-OPT1的早期版本进行的I/II期临床试验显示,DelNS1-RBD耐受性良好。在一些受试者中检测到对SARS-CoV-2的RBD的抗体和T细胞应答,但我们无法完全评估气道中的特定免疫应答。在安全特性和有前景的临床前证据的支持下,目前在几个国家正在进行第III期试验,评估该疫苗候选疫苗对当前肌肉注射SARS-CoV-2疫苗策略的潜在贡献。为了进一步增强DelNS1-RBD LAIV的免疫原性并解决有关新兴变异株的担忧,本研究提供了有关DelNS1-RBD疫苗候选疫苗的改进版本的数据,在动物模型中对当前变异株进行了测试。我们的结果显示,促进RBD在细胞表面表达的DelNS1-RBD4N-DAF LAIV在诱导中和抗原抗体方面具有很高的免疫原性,包括对原始SARS-CoV-2株和当前变异株(包括Omicron BA.2)的中和抗体。值得注意的是,与mRNA疫苗的肌肉注射相比,DelNS1-RBD4N-DAF LAIV的经鼻接种可以阻断随后感染的仓鼠的肺部和鼻甲板中的病毒复制。这种流感载体疫苗有潜力作为独立的二针法或补充增强免疫来控制SARS-CoV-2的传播,并且可能被开发成既能预防COVID-19又能预防流感的双重功能疫苗。
结果
在NS1删除的流感病毒载体系统中,表面表达和靶向N-糖基化增强了SARS-CoV-2刺突RBD的免疫原性。
流感病毒的非结构蛋白1(NS1)在病毒的生命周期中发挥着关键作用。【21.22】我们先前报道了一种减弱的流感病毒载体系统,可以用来从NS1删除位点(DelNS1-RBD)表达SARS-CoV-2的受体结合结构域(RBD)。当经鼻给药时,这种疫苗候选疫苗已被证明可以有效增强动物的系统和黏膜免疫应答。本研究通过向该系统中添加膜锚定蛋白衰减加速因子(DAF)的基因来进一步修改这一系统,以增强RBD在细胞表面的表达。将SARS-CoV-2 RBD与跨膜和细胞质域的DAF融合,确保它将被正确处理并呈现在DelNS1-RBD-DAF LAIV感染细胞的细胞表面。正如在感染的MDCK细胞中所示,表达RBD-DAF融合蛋白的病毒载体导致高水平的膜显示RBD,与编码不带DAF的RBD的载体相比(见图1B)。为了测试DAF的包含是否确实增强了对RBD的免疫应答,我们使用二针法接种(见图1D)
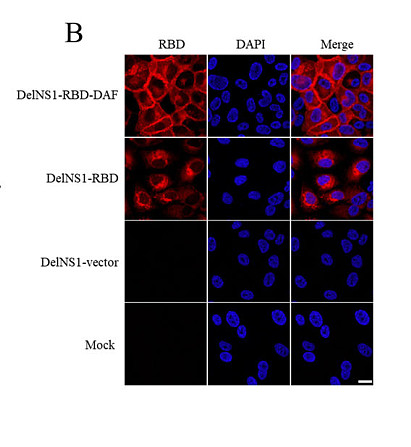

对小鼠进行了DelNS1载体、DelNS1-RBD或DelNS1-RBD-DAF LAIV的免疫,然后在主免疫后六周测量了RBD的总抗体和对表达SARS-CoV-2刺突蛋白的假病毒的中和活性。DAF的包含显著增加了小鼠体内的总抗RBD和中和抗体水平。同样关键的是诱导高度特异性免疫应答到位于SARS-CoV-2 RBD核心ACE2受体结合区域内的表位。已知刺突的糖基化可以保护病毒抗原,并可能影响刺突蛋白表位的暴露,供免疫细胞识别。我们认为通过在受体结合基序RBM外部修饰四个残基(A372T、G413N、D428N和P521N)来糖基化(4 N),从而掩盖非ACE2竞争性表位,RBM内的表位可能更加突出呈现。
为了测试这一假设,我们在小鼠模型中使用DelNS1-RBD-DAF LAIV系统检验了来自Beta(B.1.351)或Delta(B.1.617.2)变异株的RBD和RBD4N的免疫应答。小鼠经鼻接种DelNS1载体或Beta或Delta版本的DelNS1-RBD4N-DAF或DelNS1-RBD-DAF LAIV(图1D),然后使用代理ELISA和假病毒分别测量对RBD(WT,A系病毒)的总抗体和中和活性。 Beta和Delta RBD的4N版本(Beta4N、Delta4N)诱导了比不带4N修饰的RBD更高水平的抗体。

中和活性实验显示,对于Beta和Delta RBD,额外的N-糖基化增强了对表达Beta、Delta或Omicron BA.1变异株刺突蛋白的假病毒的中和抗体应答。这些数据表明,融合膜锚定蛋白DAF以促进RBD的表面表达,并针对额外的N-糖基化以掩盖非ACE2竞争性表位,增强了该流感病毒载体疫苗系统中RBD的免疫原性。
DelNS1-RBD4N-DAF变体的免疫原性
自2022年初奥密克戎亚型成为主要流行毒株,取代了Delta和较早的变异株以来,对编码Beta、Delta或Omicron(BA.1)RBD的DelNS1-RBD4N-DAF疫苗候选疫苗(分别为Beta4N-DAF、Delta4N-DAF或BA.1 Omi4NDAF)的免疫原性进行了评估,并与BioNTech mRNA疫苗在动物中进行了比较,采用如上所述的二针法方案。

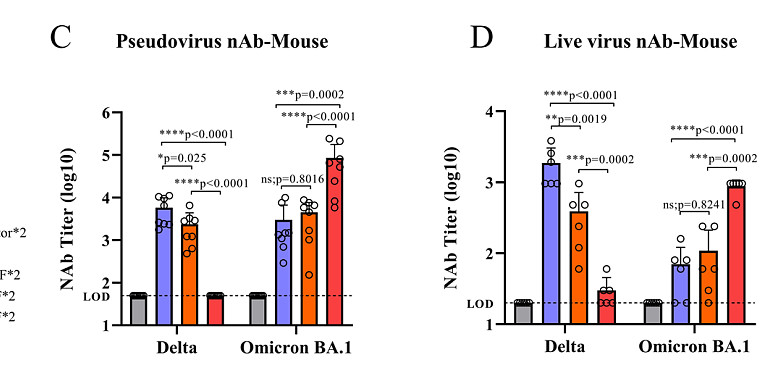
Delta和Omicron(BA.1)DelNS1-RBD4N-DAF LAIV疫苗候选疫苗均在小鼠中诱导了高水平的针对原始SARS-CoV-2株RBD的抗体,但中和活性实验使用假病毒或活病毒显示,每个RBD诱导了更多的株特异性抗体,尤其是Omicron RBD。为了检查DelNS1-RBD4N-DAF LAIV是否诱导黏膜免疫应答,我们测量了从免疫小鼠中获得的支气管肺泡灌洗(BAL)液中的抗-RBD IgA。
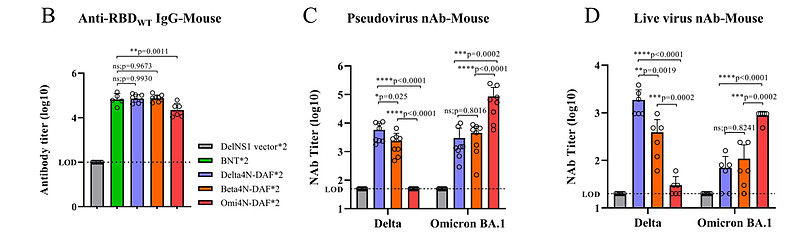
我们的结果显示,从DelNS1-RBD4N-DAF LAIV中表达的Delta和Omicron RBD均诱导了针对原始SARS-CoV-2株的IgA。在仓鼠中,Delta和Beta DelNS1-RBD4N-DAF经鼻疫苗候选疫苗诱导了比两剂BioNTech mRNA疫苗更高水平的RBD特异性抗体。与免疫小鼠的结果类似,使用假病毒或活病毒的中和活性实验清楚地显示了在仓鼠模型中每个疫苗候选疫苗的株特异性中和活性。与其他报告一致,原始SARS-CoV-2(A系列和BioNTech mRNA疫苗的基础)、Delta和Beta刺突表位使用假病毒和活病毒均只诱导少量对Omicron变体BA.1和BA.2的交叉中和抗体。值得注意的是,BNT162b2在小鼠中诱导出与BA.1 Omi4N-DAF对野生型RBD相似或更高水平的IgG,但在仓鼠中产生的IgG水平较低。推测不同物种的细胞对mRNA疫苗的摄取可能不同,这种差异可能会影响免疫应答。这些结果表明,来自SARS-CoV-2不同变体的RBD具有免疫原性,能够诱导针对SARS-CoV-2刺突蛋白RBD的血清中和抗体和黏膜IgA,但株特异性存在显著变异。
DelNS1-RBD4N-DAF LAIVs诱导CD4+和CD8+ T细胞应答
SARS-CoV-2特异性T细胞在清除病毒和预防人类严重疾病中起着关键作用。在小鼠中评估了代表SARS-CoV-2 Delta和Omicron变体的DelNS1-RBD4N-DAF LAIVs诱导的RBD特异性T细胞。小鼠通过经鼻途径接种两剂DelNS1载体或含有Delta或Omicron(BA.1)版本RBD的DelNS1-RBD4N-DAF,两次接种相隔四周,然后在增强免疫后的10天内评估肺部和脾脏的急性期T细胞应答。

预期地,经鼻给药会在肺部比在脾脏触发更强的T细胞应答,进一步证实经鼻免疫可以更好地诱导特异的气道免疫。虽然Delta DelNS1-RBD4N-DAF诱导了相似水平的CD4+和CD8+ T细胞,但Omicron RBD(BA.1)似乎在免疫小鼠的肺部和脾脏中诱导了强烈的CD4+应答,但CD8+ T细胞的水平要低得多。

这可能是由于所使用的肽池是基于父母SARS-CoV-2(A系)株的。与Delta相比,Omicron的RBD区域中来自父母(A系)株的变异更多。尚待调查Omicron变体是否诱导与父母株和以前的SARS-CoV-2变体不同的CD8+ T细胞群体。与识别野生型病毒的CD4+ T细胞相比,识别Omicron的CD8+ T细胞增殖减少,这观察到的是在感染或接种的个体中。为了评估记忆T细胞应答,小鼠通过二针法接种DelNS1载体或BA.1 Omi4N-DAF(BA.1 RBD)LAIVs,并在小鼠被处死前立即静脉注射CD45特异性抗体以标记外周T细胞。在BA.1 Omi4N-DAF免疫的小鼠中检测到了CD4+和CD8+记忆期T细胞,而在载体免疫的对照组中未检测到。这些结果表明,经鼻途径免疫DelNS1-RBD4N-DAF可以诱导肺部和脾脏的急性和记忆期T细胞应答,而肺部中存在更高水平的急性期T细胞。
DelNS1-RBD4N-DAF LAIVs诱导对SARS-CoV-2感染的无感染免疫
(在病原体诱发感染之前就将其消除)
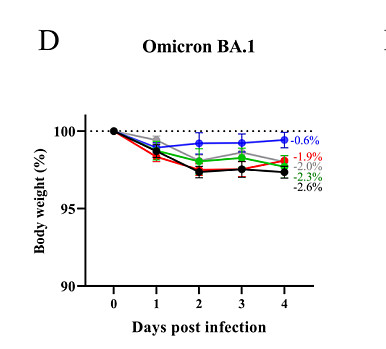
在评估中和T细胞应答后,我们通过接种DelNS1-RBD4N-DAF LAIVs来检查小鼠和仓鼠对SARS-CoV-2感染的保护作用。为了便于使用小鼠模型进行病毒暴露实验,我们制备了经小鼠适应的(MA)SARS-CoV-2毒株,包括Gamma(P.1)和Omicron BA.1变体。这些MA毒株在小鼠中有效复制并引起明显的体重减轻和疾病(图4A、B和附加数据表2A、B)。

Omicron变体对免疫逃逸已在接种疫苗或通过早期变体感染的人类中进行了广泛报道。Delta-RBD对Omicron BA.1和BA.2的交叉变异抗体水平较低,而Omicron-RBD则产生了更多的特异性抗体(图2C、D、G)。

值得注意的是,接种Delta或Omicron(BA.1)DelNS1-RBD4N-DAF LAIVs可以完全预防小鼠的体重减轻,并在肺组织中保护它们免受SARS-CoV-2感染,在接种小鼠适应的Omicron毒株(BA.1)后的第2和第4天,无法检测到病毒(图4)。

其他免疫防御机制,包括特异性T细胞和黏膜IgA,可能共同作用于阻止和清除受病毒暴露的病毒。相比之下,未接种的小鼠在攻毒试验后的第4天失去了超过11%的体重,并且仍然在肺部具有高水平的病毒滴度。在使用小鼠适应的SARS-CoV-2 Gamma(P1)变体病毒暴露后,接种Delta4N-DAF的小鼠也观察到类似的结果。仓鼠是SARS-CoV-2感染的更易感实验室动物模型之一,模拟人类COVID-19疾病的临床和病理表现。我们比较了仓鼠在接受肌肉原型BNT162b2 mRNA或经鼻DelNS1-RBD4N-DAF(Omicron BA.1或Delta RBD)疫苗的二针法后,或者是BNT162b2 mRNA二针法,随后是第二次助剂为BNT162b2 mRNA或DelNS1-RBD4N-DAF经鼻疫苗后,对抗体诱导的比较(图5A和附加数据表3A)。

所有接种方案对父母SARS-CoV-2株(A系)的RBD都诱导了相当水平的抗体(附加数据表3B)。基于假病毒的中和试验提供了了解每种免疫组合诱导的特异性中和活性的信息。与早期报告一致,Delta VOC主要逃避了两剂BNT162b2 mRNA诱导的抗体,而肌肉注射BNT162b2 mRNA或经鼻DelNS1-RBD4N-DAF疫苗(Delta或Omicron BA.1 RBD)的第3剂助剂诱导了对Delta VOC的中和活性,正如Delta4N-DAF的双剂量(图2G)所示。
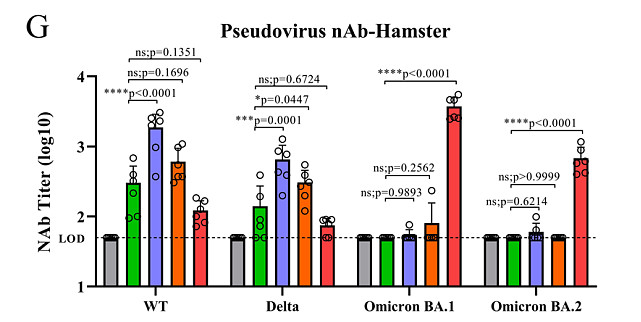

然而,两剂BA.1 Omi4N-DAF经鼻疫苗只诱导了对Delta变体的低水平中和抗体(图2G)。相反,除了两剂BA.1 Omi4N-DAF疫苗外,所有组合均未能在仓鼠中诱导出对Omicron变体(BA.1和BA.2)的显著水平的中和抗体(图2G、H和3C)。我们接下来评估了经鼻免疫通过DelNS1载体、Delta4N-DAF或BA.1 Omi4N-DAF LAIVs诱导的保护效果,并将其与BioNTech mRNA疫苗肌肉注射免疫进行了比较。使用Delta、Omicron BA.1和Omicron BA.2变体进行了病毒暴露实验,以了解所测试的DelNS1-RBD4N-DAF疫苗提供的交叉保护作用(图5A)。对Delta变体的病毒暴露导致对照和大多数接种的仓鼠发生显著的体重减轻(约6%),除了接种Delta4N-DAF的仓鼠,它完全预防了体重减轻(图5B和附加数据表3D)。与体重的保持一致,接种Delta4N-DAF LAIV预防了Delta病毒暴露后的肺部和鼻甲骨的病毒感染(图5C)。使用BNT162b2 mRNA疫苗(基于A系株)的肌肉二针法或者是BNT162b2 mRNA的二针法,随后是肌肉注射的BNT162b2或经鼻Delta4N-DAF疫苗的第二次助剂,使Delta变体在肺部和鼻甲骨的复制减少了10倍或更多(附加数据表3E)。然而,接种BA.1 Omi4N-DAF LAIV未能阻止Delta在仓鼠中的复制(图5C)。

我们接着测试了BA.1 Omi4N-DAF LAIV是否能预防Omicron变体的感染。Omicron变体在已免疫人类中引起较轻的疾病,在动物模型中的致病性较低。当接种的仓鼠病毒暴露时,与未接种疫苗的仓鼠相比,仅观察到了轻微的体重减轻(2.65%),无论是BNT162b2 mRNA的二针法,还是BNT162b2 mRNA与BA.1 Omi4N-DAF经鼻疫苗的第二次助剂,以及BA.1 Omi4N-DAF免疫仓鼠,都没有观察到明X显的体重减轻(图5D和附加数据表3F)。
肺组织和鼻甲骨中的病毒滴度测定显示,只有对特异性株BA.1 Omi4N-DAF的接种完全预防了病毒在肺部的复制,而在其中一个接种BA.1 Omi4N-DAF的仓鼠的鼻甲骨中仅检测到了极低水平的病毒(图5E)。有趣的是,接种Delta4N-DAF也显著减少了Omicron感染动物的肺部病毒复制,并完全阻止了鼻甲骨中的病毒复制(图5E),这表明经鼻接种Delta4N-DAF具有对Omicron变体的显著交叉保护作用。

然而,肌肉注射的两剂或三剂BNT162b2 mRNA疫苗在感染动物的肺部和鼻甲骨中的病毒滴度并未明显减少,而两剂BNT162b2 mRNA加上一剂BA.1 Omi4N-DAF经鼻助剂则使感染动物肺部的病毒滴度降低了100倍(附加数据表3G)。Omicron BA.2亚系及其后代(BA.2.12.1和BA.4/5)比Omicron BA.1更具传播性,并且自2022年初以来已成为许多国家的主要毒株。我们比较了BNT162b2 mRNA和BA.1 Omi4N-DAF疫苗对随后病毒暴露的Omicron BA.2毒株的有效性。病毒暴露Omicron BA.2导致了未接种疫苗的仓鼠超过6%的体重减轻,而接种了BNT162b2 mRNA和BA.1 Omi4N-DAF的体重减轻在一定程度上得到了减轻,BA.1 Omi4N-DAF的效果更强,BNT162b2 mRNA的三剂次接种或两剂次接种再加上一剂BA.1 Omi4N-DAF助剂的免疫方案(图5F和附加数据表3H)。

呼吸道组织中病毒滴度的测定显示,只有BA.1 Omi4N-DAF接种完全阻止了病毒的复制,肺部和鼻甲骨在攻毒试验后第4天无病毒检出,而其他免疫组合则未能抑制肺部的病毒复制,也未能阻止鼻甲骨中的病毒排泄(图5G),而BNT162b2 mRNA(两剂和三剂)或两剂BNT162b2 mRNA加一剂BA.1 Omi4N-DAF经鼻助剂在感染动物的肺部病毒滴度有所降低,但在鼻甲骨中未见明显效果(图5G和附加数据表3I)。

组织病理学检查确认了不同疫苗在小鼠和仓鼠中的保护效果。这些结果表明,经鼻免疫DelNS1-RBD4N-DAF疫苗可以提供对SARS-CoV-2感染的几乎无菌免疫。早期变体诱导的交叉变体免疫对最新的Omicron VOC也是可能的。
DelNS1-RBD4N-DAF LAIV可以作为流感和SARS-CoV-2的双重功能疫苗
SARS-CoV-2无法被根除,很可能会继续进化并与其他冠状病毒和流感病毒在人类中共同流行。共流行的SARS-CoV-2和流感病毒可能导致年度流行病。定期接种以增强对新出现的SARS-CoV-2变异的免疫力可能是必要的,就像对季节性流感一样。将流感和SARS-CoV-2结合在一起的双重功能疫苗可能是未来管理这些病毒的选择之一。我们先前已经显示,DelNS1活病毒具有潜力成为另一种活病毒流感疫苗,因为它具有高度衰减和免疫原性特性。本研究进一步测试了我们上面显示的DelNS1-RBD4N-DAF LAIV对SARS-CoV-2的保护作用,是否也可以用于对抗流感病毒感染。CA4-DelNS1-RBD(H1N1)和HK68-DelNS1-RBD(H3N2)LAIVs在病毒暴露前被用于免疫小鼠,然后病毒暴露分别是小鼠适应的H1N1或H3N2病毒。我们的结果显示,使用CA4-DelNS1-RBD(H1N1)和HK68-DelNS1-RBD(H3N2)进行二针法后,小鼠对病毒暴露的致命剂量的H1N1或H3N2小鼠适应病毒完全受到了保护,并且完全阻止了病毒在肺组织中的复制。检查对流感病毒血凝素(HA)的特异性抗体和识别流感病毒核蛋白(NP)的T细胞显示,DelNS1-RBD4N-DAF LAIVs保留了在免疫小鼠中诱导免疫应答的能力。为了评估预先存在的抗流感免疫对Omicron DelNS1-RBD4N-DAF LAIV的免疫原性和保护能力的潜在影响或干扰,我们测试了先前感染流感病毒对我们疫苗的影响,并发现使用的二针法接种能够在以前感染与DelNS1-RBD4N-DAF疫苗相匹配的亚致命剂量的流感毒株的小鼠中诱导出强大的SARS-CoV-2特异性抗体和中和抗体。在病毒暴露后的第2和第4天,小鼠对小鼠适应的Omicron BA.1-MA毒株的SARS-COV-2充分受到保护,在肺组织中没有检测到病毒滴度。这些结果表明,DelNS1-RBD4N-DAF流感病毒载体疫苗平台有望成为一种针对流感和SARS-CoV-2病毒感染预防的双重功能疫苗。
讨论
SARS-CoV-2继续通过出现具有免疫逃逸能力和更有效传播的最佳宿主适应性的变异株在人类中流行。全球人口正在逐渐通过疫苗接种或获得的感染建立起对SARS-CoV-2感染的基本免疫力。然而,SARS-CoV-2变异株的活跃流行仍然导致大量的二次感染,影响人类健康。目前的疫苗接种计划已经有助于缓解COVID-19疾病,但不会提供长期的免疫力以将SARS-CoV-2变异株的流行水平保持在较低水平。下一代COVID-19疫苗应该专注于预防感染和/或减少传播。诱导更强的黏膜免疫力的经鼻途径传递的疫苗是疫苗开发的一个方向。最近的一项研究显示,鼻黏膜IgA和血浆IgG抗S1(Spike)抗体反应之间没有关联,并建议进行经鼻增强接种以增强鼻黏膜免疫力并减少二次感染。尽管一些经鼻疫苗候选疫苗目前正在进行临床试验,但我们在中国获得了针对COVID-19的基于流感的DelNS1-RBD LAIV经鼻疫苗的紧急使用批准。我们先前报道了基于流感的DelNS1-RBD疫苗,证明了这些经鼻疫苗的二针法或与肌肉疫苗候选联合使用能够诱导强大的系统和黏膜免疫反应,阻止了SARS-CoV-2在小鼠模型中的感染。在本研究中,我们进一步评估了经鼻疫苗载体DelNS1-RBD4N-DAF在小鼠和仓鼠模型中的修饰版本。目前的版本具有两个重要特征;添加了一个膜锚定基序DAF,优化了细胞表面RBD表达,引入了四个N-糖基化位点,用于保护受体结合位点(RBM)以外的表位,并鼓励生成特异性抗ACE2竞争表位的抗体。我们表明,表达自SARS-CoV-2变体的各种RBD的DelNS1-RBD4N-DAF LAIV是免疫原的,并且能够诱导针对SARS-CoV-2 RBD的系统和黏膜特异性免疫,并在某些情况下对小鼠和仓鼠模型中SARS-CoV-2变异株的感染进行有效保护,甚至可能产生交叉保护。这些基于流感的DelNS1-RBD4N-DAF疫苗通过诱导呼吸道组织中的免疫力,并提供近乎消毒的免疫力,使自己区别于其他疫苗。经鼻免疫特别诱导上呼吸道组织的黏膜免疫。最近的一项研究报道了一种经鼻Ad载体疫苗,该疫苗表达了SARS-CoV-2的刺突、核蛋白和RdRp抗原,与肌肉注射相比,在小鼠模型中诱导了对SARS-CoV-2病毒暴露的复杂免疫,表现优于肌肉注射。2022年12月,中国首次批准了针对COVID-19的第一种经鼻喷雾疫苗,标志着这项技术的重要里程碑。大约二十年前,基于冷适应突变体的活病毒流感疫苗首次在人类中使用。流感病毒以前从未被用作其他病毒性疾病的疫苗载体,部分原因是其紧凑和分段的病毒基因组。在NS1删除(DelNS1)流感病毒中鉴定适应性突变,使其能够在孵化的鸡胚和MDCK细胞中复制,为使用流感病毒开发新的活病毒流感疫苗和其他病毒性呼吸道感染提供了机会。由于流感病毒的NS1蛋白是关键的毒力因子和免疫调节因子,因此从流感病毒的基因组中删除NS1基因将使NS1删除突变病毒成为更好的免疫原,以触发宿主免疫应答。事实上,我们以及其他研究表明,从病毒基因组中删除NS1会增强小鼠模型中DelNS1活病毒的免疫原性。本研究中描述的新的DelNS1-RBD4N-DAF LAIV载体中包括DAF以进行细胞表面呈现,并对非ACE2竞争表位进行选择性糖基化,显着增强了免疫原性。DelNS1-RBD4N-DAF LAIV经鼻免疫模拟自然流感病毒感染,将RBD抗原输送到上呼吸道组织中。删除NS1使得这种流感病毒载体对人类使用极其安全,正如在I/II期临床试验中所示。值得注意的是,DelNS1 LAIV被发现在感染的细胞中诱导高水平的干扰素β。因此,这种载体也可以作为一种佐剂,以增强针对抗原的免疫反应。与当前用于COVID-19的疫苗相比,这个系统的一个重要特性是能够诱导免疫,预防疾病并阻止上呼吸道中的病毒复制,这是下一代疫苗中迫切需要的属性,以减缓或停止SARS-CoV-2变异株的传播。最重要的是,通过包含与流行性流感株相匹配的HA和NA,DelNS1-RBD4N-DAF LAIVs可以被构建成对应季节性流感和SARS-CoV-2双重流行的双功能疫苗。