核酸药物种类及原理:
核酸药物包括小干扰RNA(siRNA),小激动RNA(saRNA),微小RNA(microRNA),信使RNA(mRNA)。
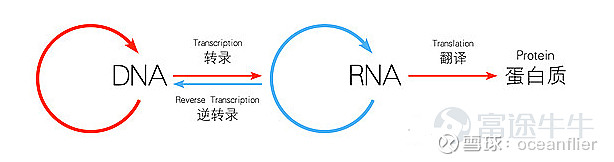
mRNA疫苗原料为信使RNA,单链,不需要进入细胞核,无外源基因片段整合到基因组的风险。mRNA进入细胞后转染后生成的蛋白就有更好的构象和活性。且mRNA疫苗好生产、成本低,可通过简单的复制模板快速获得。而因为单链结构,mRNA非常脆弱,易被体内的酶降解。分子量大,亲水性强,是小分子药物的上千倍。影响mRNA成药性的关键就是载体和输送技术。mRNA疫苗需要特殊的修饰和递送系统,以实现细胞内表达。自身携带负电荷,难以通过细胞膜进入细胞内。
主要成分:
LNP是当前主流的mRNA疫苗载体,主要是辉瑞和moderna两家在使用。LNP的结构当前仍处于不断变化的过程,学术界对其认知也在不断变化。主要包括四类成分,带负电的mRNA,可电离带正电荷的脂质,二者靠电荷吸引力形成小单元,外部又包装上辅助脂质如中性磷脂和胆固醇。而LNP表面也会由于可电离脂质带正电,而更好的结合细胞。聚乙二醇在颗粒表面可屏蔽血浆蛋白等成分结合颗粒,以避免LNP颗粒在体内被清除。
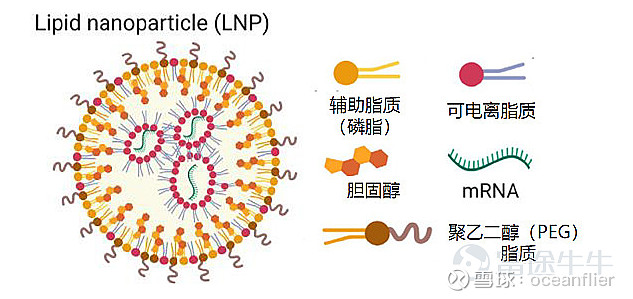
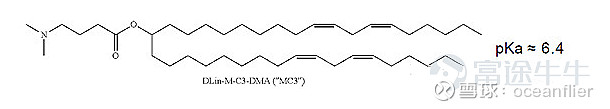
阳离子脂质80年代就存在,但从细胞试验到人体试验经历了很多年的尝试,其细胞毒性非常强,解决对人体的副反应是关键。因此可电离阳离子脂质是LNP技术的核心,也是专利保护的重点。

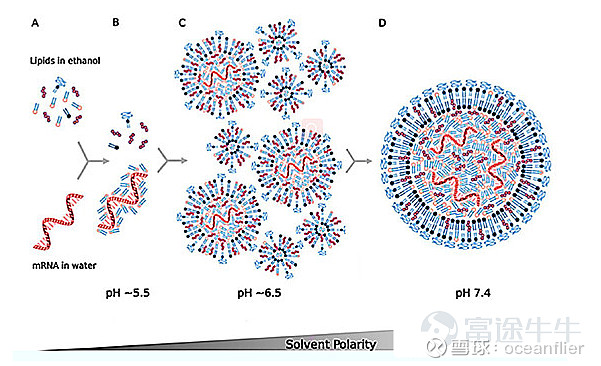
PH=4时,脂质分子中的氮会完全带正电荷。生理条件下,PH=7.4,脂质基本不带电,在保持一定的细胞结合能力的情况下减弱细胞毒性。进入细胞之后,脂质体形成内涵体PH达到5,由于其带正电,与内涵体膜上的负电荷脂质结合使内涵体破裂,将mRNA释放出来避免最后被溶酶体降解。所以可电离阳离子脂质最大的优点就是有效降低LNP细胞毒性,提高mRNA的体内稳定性,并帮助mRNA逃避溶酶体的降解。
其它辅助脂质是人体中本身就存在的常见脂质,他们使nanoparticle变得完整,主要作用是破坏细胞膜脂质双层结构,增加转染活性。而PEG存在表面会妨碍纳米颗粒与细胞的结合,所以LNP最理想的状态就是在血液中带上PEG的小帽子保护其免于血浆蛋白的降解,到细胞表面后脱落以避免影响LNP与细胞结合。因此PEG的作用就是防止颗粒聚集,增加循环稳定性。

制备方法:
$Moderna(MRNA.US)$ 等公司在递送系统的脂质配比上是非常相似的,LNP的处方都是可电离阳离子脂质占一半,剩下10%是中性脂质,38-40%是胆固醇。但是3家的疫苗给药剂量差别很大,主要跟mRNA的修饰方法有关,跟保护剂的成分如盐、糖等使用相关。
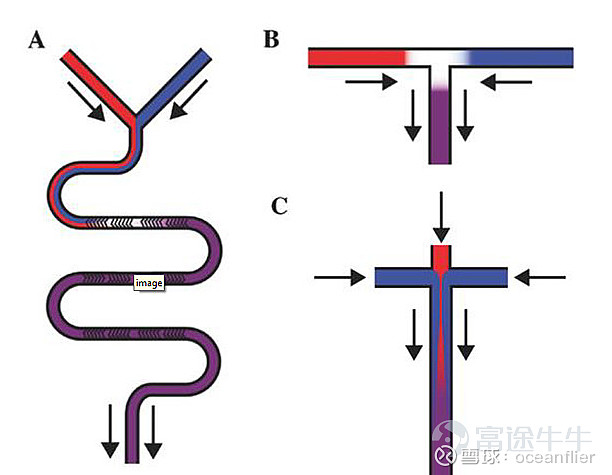
mRNA的制备在实验室和工业生产是比较类似的。LNP和mRNA的颗粒是通过自组装形成,通过两种液体按照合适的流速和配比形成。基本原理:T型管一端是RNA的水溶液,一端是脂质的乙醇溶液,通过两相的快速混合是溶液极性快速增加使脂质分子过饱和,从而让LNP完成自主装。需要控制水相和乙醇相的流速比,设计管道的形状。额外的气相流超滤替换溶液的PH值使LNP表面的阳离子脂质尽量不带电,并除掉乙醇,最后进行灌装。
开发现状:
开发mRNA疫苗难点有两个:1.规避专利设计可电离阳离子脂质及脂质的工业化生产。比如脂质每条链的两个双键正确的连接。目前国内没有自产的可电离阳离子脂质。2.工业生产设备,从微流控到T型混合装置,需要有既懂得制剂学,又懂得制药工程的人才,能清楚流速从小到大混合装置内反应如何变化。
目前是艾博生物国内做的最成熟的,虽然没提用到的可电离阳离子脂质是什么,但其它脂质比例是和辉瑞Moderna都是一样的。如果不能绕过可电离阳离子脂质专利,是很难上市卖钱的。
斯微生物的载体是用LPP,即用粉红色的带正电的聚合物把核酸药物聚合起来,并总装一层外包脂质降低细胞毒性,并使其更容易进入细胞。

丽凡达生物用阴离子脂质DOPS 替代了 辉瑞和 Moderna 处方中的中性脂质 DSPC。
$圣诺生物(688117.SH)$ 使用的载体为分枝状的组氨酸和赖氨酸的多肽共聚物,主要适用于输送 siRNA。
专利关系:
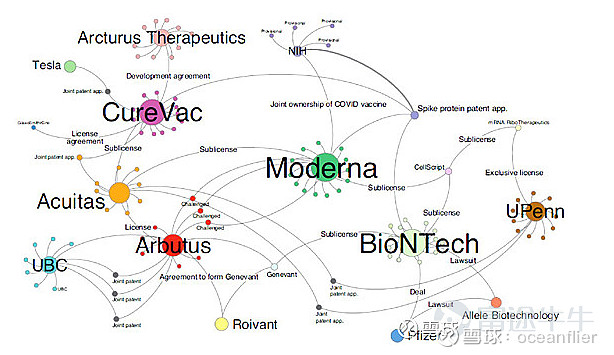
mRNA技术起源于20多年前,主要来自UBC和UPenn。后面发现LNP可以很好的解决mRNA成药性,所以针对LNP专利产生了很多的授权。
发展趋势:
1.如何提高疫苗在较高温度的稳定性 :冷冻干燥或者新的保护剂
进展:
Arcturus 的冻干疫苗在新加坡进行 III 期临床;
CureVac的疫苗可在 4 度冰箱中保存 3 个月;
2.如何降低剂量 :自复制 mRNA 技术(伦敦帝国学院和 Arcturus I 期临床)新的mRNA 序列和新的脂质
3.将注射 2 针减少为只注射 1 针:自复制mRNA 技术( 宣称单针注射后达到了免疫效果)类似于蛋白疫苗的缓控释技术,使mRNA 在不同时间释放,获得类似于两次注射的免疫效果;
4.核酸药物的发展趋势:
(1)新的治疗靶点:目前治疗性核酸药物主要是靶向肝脏;
(2)肿瘤疫苗
(3)用于基因编辑
(4)通过替换 LNP 中的其他脂质,规避可电离阳离子脂质的专利壁垒。