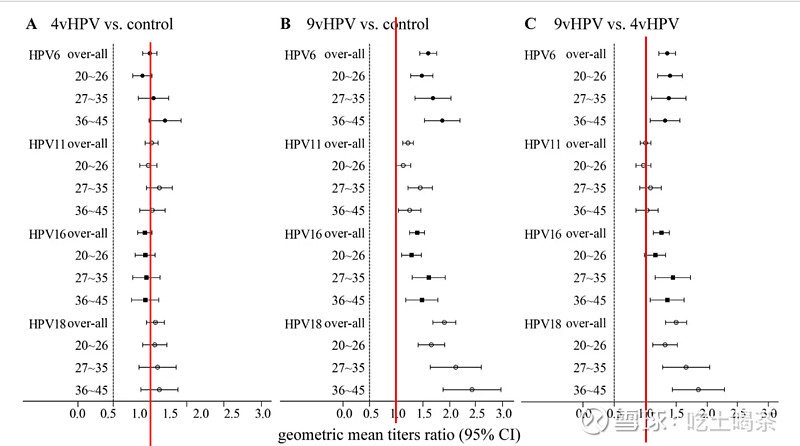
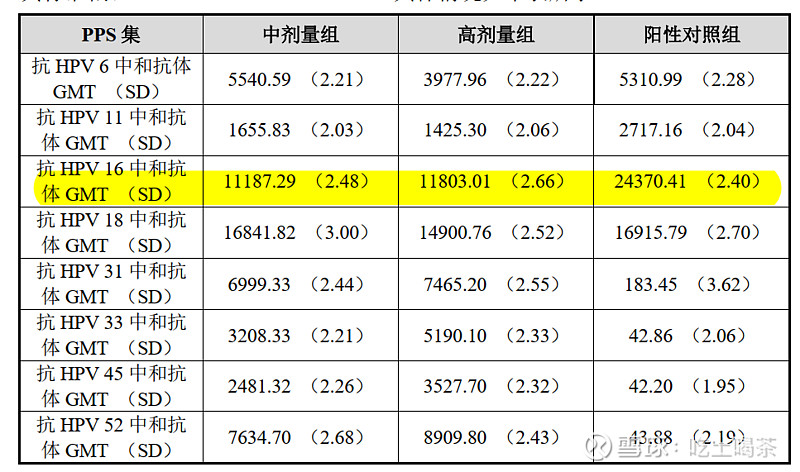
看到球友讨论不同疫苗公司九价临床,翻出指导意见,再来做下很多年没做过的语文阅读理解。
1:关于迭代疫苗的对照组,不需要设置安慰剂组,优先选择自行研发****的上一代疫苗作为对照,但是只说了优先选择,也就是说可以选别的,只要符合里面说的那些条件。----这么理解没错吧
2:“可基于免疫原性比较进行有效性评价”的前提是“以自行研发的上一代疫苗作为对照时”,如果不是自行研发的上一代疫苗,怎么判定共有型别有效性,没说。----这么理解没错吧
3:“可接受以病毒学终点 12 个月 PI(PI12)申报上市”这句话前面的条件,有三点,第一点“上一代疫苗采用公认的组织病理学终点完成保护效力试验”,第二点“经评估上一代疫苗的保护效力符合上市要求”,第三点“且试验疫苗经药学评估确属迭代疫苗”,三点都要满足,没说满足第一点就可以迭代。----这么理解没错吧

人数少的临床,真的变数很大,看不懂。
一个是1680/3,一个是780/2,两家公司,对照组一样。