本帖旨在记录JK07的研发历程,记录内容均来自公司公告、年报、网站等。
时间线:
1. 2020-02-25 Ⅰ期临床获批
2. 2022-03-08 Ⅰ期第一组数据读出
3. 2022-05-24 Ⅰ期第二组数据读出
4. 2022-09-08 Ⅰb中期数据读出
5. 2023-10-11 美国心衰协会(HFSA)口头报告Ⅰb数据
6. 2023-11-23 Ⅱ期临床获批
7. 2024-03-25 中美临床升级为国际多中心临床,并聘请国际CRO负责实施
8. 2024-04-23 Ⅱ期首例美国患者入组
以下是公告关键内容摘要:
时间:2020-02-25
来源:关于JK07获得美国FDA药品临床试验批准的公告
JK07 是美国Salubris自主研发、具有全球知识产权的NRG-1(神经调节蛋白-1)融合抗体药物,拟开发适应症为慢性心衰。
NRG-1是一组含有表皮样生长因子结构域蛋白,它通过激活酪氨酸激酶蛋白受体(HER3、HER4)调控细胞生长与分化,包括对神经系统和心脏的正常发育及功能产生重要作用。JK07分子设计独特,解决了重组NRG-1蛋白疗法的局限性,在不影响HER4激活的情况下阻断HER3受体功能,大幅提高了产品的成药性和安全性。临床前研究结果显示,产品具有半衰期长、安全性好的特点。在非人类灵长类动物自发性慢性心衰模型中,JK07能够逆转心肌病变、显著改善心脏收缩功能,治疗效果突出,目前国内外尚无同靶点的药物上市,具有较大的开发潜力。
心力衰竭是心肌结构和功能的变化导致心室射血和(或)充盈功能低下而引起的一组复杂的临床综合征,是各种心脏疾病的严重和终末阶段,5年死亡率可达50%,被称作21世纪心血管疾病的主战场。国外研究显示,慢性心衰影响全球约2%的成年人口,全球患病人数超过2300万人,美国心衰患者约610万人,每年新增病例50万人;心力衰竭因其高发病率和死亡率已成为美国主要公共卫生问题之一。而在国内,随着老龄化加剧,冠心病、高血压、糖尿病、肥胖等慢性病的发病率呈上升趋势,医疗水平的提高使心脏疾病患者生存期延长,导致我国心衰患病率亦呈持续升高趋势。
现有心衰治疗药物只能改善症状,但患者死亡率仍居高不下,治疗效果并不理想。通过修复受损的心肌细胞治疗慢性心衰是长期以来科学家致力解决的医学难题。迄今为止,尚无一种药物能够通过直接改善心肌细胞的结构和功能来治疗心衰。JK07为拥有创新作用机制的药物,有望通过改善心肌细胞结构和功能治疗慢性心力衰竭,若能成功开发上市,将在一定程度上满足抗心衰领域未被满足的临床需求,进一步丰富公司心血管领域创新产品线。
时间:2022-03-08
来源:关于JK07美国临床试验进展的公告
JK07的I期临床试验为随机、双盲、安慰剂对照、剂量递增研究。I期临床第一组受试者(n=5)的试验数据初步表明,与安慰剂组相比,JK07具有良好的安全性和潜在的临床获益信号,左心室射血分数绝对值相对基线最大改善达到18%(相对改善大于50%)。目前,美国Salubris正进行第二组临床试验的入组工作。
时间:2022-05-24
来源:关于JK08提交CTA及JK07美国临床试验进展的公告
JK07的I期临床试验为随机、双盲、安慰剂对照、剂量递增研究。I期临床第二组受试者(n=5)已完成入组,试验数据初步展示了JK07具有良好的安全性和潜在的临床获益信号。目前,SalubrisBio正进行第三组临床试验的入组工作。
时间:2022-09-08
来源:关于JK07、JK08境外临床试验进展的公告
JK07的I期临床试验为随机、双盲、安慰剂对照、剂量递增研究,目前,美国正开展JK07的I期临床第三组患者入组,并获得Ib期临床试验中期分析数据。数据显示,与安慰剂组对比,JK07显示出良好的安全性和潜在的临床获益信号。
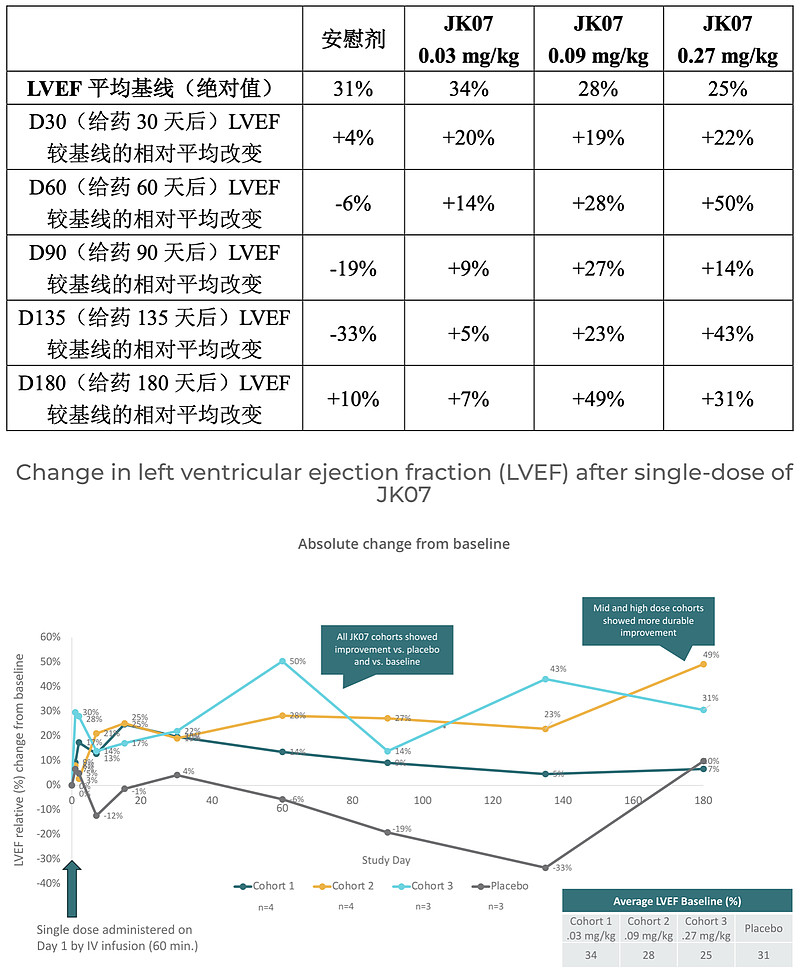
Ib期的中期分析涵盖了三个剂量组中的11名NYHA II/III级心衰患者。前两组接受JK07给药的患者中,可观察到JK07与LVEF(左心室射血分数)的改善显示出剂量相关性趋势,其中,第二组(剂量 0.09mg/kg)接受JK07给药的患者在给药90天后(D90)平均LVEF 绝对值相对基线的改善达30%。第三组(剂量0.27mg/kg)哨兵患者在给药30天后(D30),LVEF相对改善超70%(LVEF绝对值从22%提升至38%)。同时,在前两个剂量组接受JK07给药所有患者和第三剂量组哨兵患者中,可观察到靶点相关的替代生物标志物呈剂量依赖性增加,说明药物靶点尚未达到饱和。此外,JK07耐受性良好,试验迄今未见严重不良事件报告。
本次中期分析主要数据还包括:接受JK07给药的患者,D30第一组(n=4)、第二组(n=4)平均LVEF相对基线的改善结果类似:第一组平均改善达20%,第二组平均改善达19%;D90 第一组平均改善降至9%,第二组增至30%。而接受安慰剂给药的患者(n=2)D30 平均改善达4%,D90 降至14%。
JK07(0.09mg/kg)队列临床试验显示,其与同类药物在相同剂量(剂量经换算后)时的LVEF改善水平相当,但JK07与同类药物不同之处在于未观察到剂量限制毒性,推测JK07(0.27mg/kg)队列在后续临床研究中将可以显示出更高的活性。
时间:2023-10-11
来源:关于JK07境外临床试验进展的公告
近日,深圳信立泰药业股份有限公司(下称“公司”)收到子公司美国 Salubris Biotherapeutics, Inc.(下称“Salubris Bio”)的通知,其在美国心衰协会(HFSA)2023年度科学会议最新发布口头汇报专场公布了JK07治疗HFrEF(射血分数降低的心衰)的美国Ib期临床试验的积极数据。现就相关信息公告如下:
一、JK07慢性心力衰竭的HFrEF适应症试验进展
JK07的Ib期临床试验为随机、双盲、安慰剂对照、剂量递增研究,目前试验已完成并获得完整分析数据。数据显示,JK07显示出良好的安全性、初步疗效,并确定了治疗安全窗。在耐受剂量范围内,JK07在HFrEF的生物标志物改善、疗效指标上都有优秀的表现。JK07单次给药6个月内可使左室射血分数呈现具有临床意义的改善,这种持续的反应表明JK07具有改善患者心功能、生活质量和长期疗效的潜力。公司将在II期多次给药临床试验中进一步评估JK07 在HFrEF和HFpEF(射血分数保留的心衰)患者中的疗效和安全性。
与安慰剂组相比,JK07在所有剂量组均显示出有临床意义的 LVEF(左室射血分数)的改善,且靶点相关的替代生物标志物呈剂量依赖性改变。D180(单次给药180天后),中、高剂量组LVEF平均改善≥31%。JK07总体耐受性良好,大多数不良事件为轻度至中度,仅在最高剂量组发生一例严重不良事件(3 级)。
JK07已完成的Ib期临床研究包括三个剂量组,14名NYHA II/III 级心衰患者按3:1随机接受JK07或安慰剂治疗(11例JK07:3例安慰剂)。其中前二组(剂量分别为0.03mg/kg、0.09mg/kg)各有5名患者入组,第三组(0.27mg/kg)有4名患者入组。给药方式为单次静脉给药,评估患者 LVEF 较基线的变化。
与安慰剂组相比,JK07 所有剂量组的 LVEF 变化如下:
二、 其他相关情况
JK07(中国项目代码:SAL007,重组人神经调节蛋白1 (NRG-1)-抗HER3抗体融合蛋白注射液,下称“07”)是公司自主研发、具有全球知识产权的NRG-1融合抗体药物,是心衰领域首个进入临床开发阶段的选择性ErbB4激动剂,拟开发适应症包括 HFrEF(射血分数降低的心衰)和HFpEF(射血分数保留的心衰)。
该产品是公司第一个中美双报的创新生物药,美国、中国同时开展了I 期临床试验(HFrEF 适应症),中国的I期临床已完成两个剂量组的入组和揭盲,正进行患者随访及数据清理等工作。
美国Salubris Bio计划近期向FDA提交慢性心衰(HFrEF及 HFpEF适应症)的II期临床试验申请,预计将于2024年上半年正式启动II期临床患者入组工作。
NRG-1是一组含有表皮样生长因子结构域蛋白,它通过激活酪氨酸激酶蛋白受体(HER3、HER4)调控细胞生长与分化,对神经系统和心脏的正常发育及功能产生重要作用。JK07分子设计独特,解决了重组NRG-1蛋白疗法的局限性,在不影响HER4激活的情况下阻断HER3受体功能,大幅提高了产品的成药性和安全性。临床前研究结果显示,产品具有半衰期长、安全性好的特点,具有较大的开发潜力。
时间:2023-11-23
来源:关于JK07境外临床试验进展的公告
近日,深圳信立泰药业股份有限公司(下称“公司”)收到子公司美国 Salubris Biotherapeutics, Inc.(下称“Salubris Bio”)的通知,根据相关规则,可以在美国开展JK07慢性心力衰竭的HFrEF(射血分数降低的心衰)和HFpEF(射血分数保留的心衰)适应症的 II 期临床研究。
根据FDA相关规则,在FDA收到相关临床试验申请后30日自动生效,除非FDA提出疑虑或疑问并在该30日时期内对该临床试验施加临床限制。
目前Salubris Bio提交有关申请已届满30日,根据有关规定可以开展JK07慢性心力衰竭的HFrEF和HFpEF适应症的II期临床研究。
时间:2024-03-25
来源:2023年年度报告
报告期内,中美双报的创新生物药JK07(SAL007)已获批可以在美国开展II期临床试验(HFrEF和HFpEF适应症),将于2024年上半年正式启动II期临床患者入组,公司计划在美国、中国、加拿大等地开展国际多中心临床试验。美国的临床I期试验确认了JK07的安全性、初步疗效,并确定了治疗安全窗。在耐受剂量范围内,JK07 在HFrEF的生物标志物改善、疗效指标上都有优秀的表现。
SAL007项目的研发产品为重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液,适应证包括慢性心衰的HFrEF(射血分数降低的心衰)和HFpEF(射血分数保留的心衰),是公司第一个中美双报的创新生物药。
MRCT(国际多中心临床试验)可以增加在研项目临床样本的多样性,更好地评估药物在不同人群中的试验数据,同时可以减少不必要的重复临床试验,提高药物研发效率,缩短区域或国家间药品上市延迟。因此,本次变更后SAL007项目将采取MRCT的方式来实施。
然而,MRCT相较一般的临床试验更为复杂,通常需要企业投入大量资源,还需具备丰富的知识来进行专门管理。在MRCT的开展过程中,国际CRO机构具有更明显的优势,既能有效协调各临床中心的工作,优化资源分配,实现资源共享;又能更加有效地管理临床试验中的潜在风险,如患者招募难度、数据管理和伦理审查等。
因此,公司参与由子公司美国Salubris Biotherapeutics, Inc.牵头、委托国际CRO机构开展本募投项目产品的MRCT。同时,考虑到公司作为母公司具有更好的协调及统筹能力,本次国内实施主体计划由子公司成都信立泰变更为公司,并使用募集资金支付公司应承担的费用,如超过本项目募集资金公司将以自有资金补足。
时间:2024-04-23
来源:关于增资子公司Salubris Biotherapeutics,Inc.的公告
JK07重组人神经调节蛋白1(NRG-1-抗HER3抗体融合蛋白注射液)是公司自主研发、具有全球知识产权的NRG-1融合抗体药物,是心衰领域首个进入临床开发阶段的选择性ErbB4激动剂,拟开发适应症包括射血分数降低的心衰(HFrEF)、射血分数保留的心衰(HFpEF)。JK07是公司第一个中美双报的创新生物药,目前处于II 期临床阶段。
Salubris Bio已就II期临床研究的试验设计与FDA进行了沟通。该II期临床研究为随机、双盲、安慰剂对照、多次给药研究,计划纳入282例心衰患者,按照1:1:1的比例随机接受JK07(低剂量组)、JK07(高剂量组)或安慰剂治疗。其中HFrEF计划入组204例,HFpEF计划入组78例。目前,JK07的II期临床试验已在美国进行了首例患者入组。