7月27日,武田发布了日本财年2023Q1季度(4-6月)业报,其中显示已获批表皮生长因子受体(EGFR)Exon20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)二线治疗资格的EGFR exon 20抑制剂莫博赛替尼(TAK-788)在EXCLAIM-2研究中因无效而终止,该研究是评估药物一线治疗EGFR Exon20插入突变NSCLC。#

这可能也会让TAK-788 近年不会有什么监管性事件了
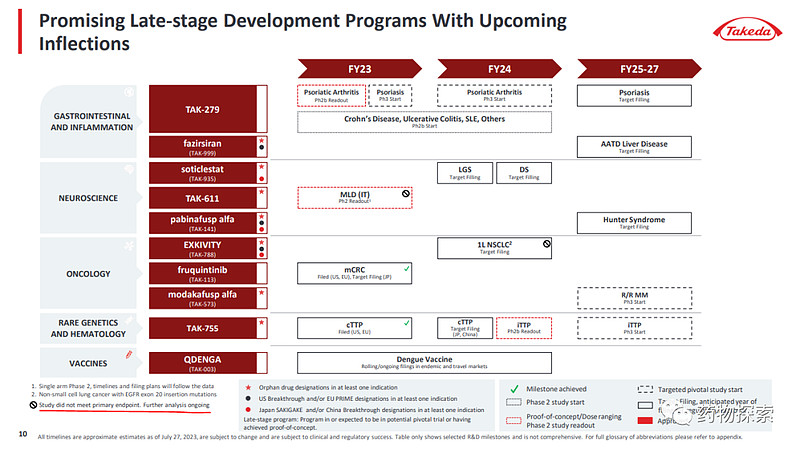
事实上,TAK-788的疗效确实不令人那么满意。现在一线失败,不知道跟随者怎么做,但对于创新者机会来了。当然,他即便不失败,也不代表没有机会,疗效和安全性就在那摆着。所以,一直说,为了所谓的“成功率”和速度可以follow,但药物不妨多储备一款,防止“带头大哥”出幺蛾子。
比如:网页链接{超4亿美元收购,EGFR exon20 格局和设计}
看上面的链接文章,3级的不良事件是什么概念?幺蛾子“大哥”也不止一个了,license in里还有不少。

但是,对于武田来说,失败的消息不止1个。酶替代疗法TAK-611也不是幸运儿.这家日本跨国公司目前正在对数据进行进一步分析,并正在寻找 TAK-611 的所有可能选择,“但考虑到这些结果,不幸的是,该项目很可能会被终止,”武田研发总裁 Andy Plump 在一份报告中表示。周四投资者电话会议。

TAK-611 设计用于鞘内给药,是一种重组人芳基硫酸酯酶 A 酶替代疗法。该候选药物正在开发用于治疗异染性脑白质营养不良(MLD),这是一种罕见的遗传性溶酶体贮积病,其特征是细胞内,特别是神经系统中脂质的致病性积聚,从而导致器官功能进行性丧失。
还没结束,前两天OX2R激动剂TAK-994的结果发表在英格兰了,由于肝脏不良事件,研究提前终止了,所以数据也就不够分析了,项目也停了。
还有武田的登革热疫苗 TAK-003 在第一财季也遭遇挫折,这家日本制药公司自愿撤回了其生物制剂许可申请。
TAK-003在英国、泰国和巴西等其他国家获得批准,并以 Qdenga 品牌销售。