2023年04月06日讯 / 香港迈极康hkmagicure / --戈沙妥珠单抗(Trodelvy)是一款同类首创的抗体与拓扑异构酶1抑制剂组成的抗体药物偶联物,靶点为TROP-2受体,该受体为一种在许多上皮癌(包括转移性三阴性乳腺癌和转移性尿路上皮癌(UC))中均过度表达的蛋白,其中高表达与低生存率和复发相关。
基于3期ASCENT研究提交的数据,戈沙妥珠单抗(Trodelvy)在全球多个国家(包括美国、欧盟、澳大利亚、加拿大、英国、瑞士等)获批用于转移性三阴性乳腺癌的二线治疗。

接着戈沙妥珠单抗(Trodelvy)在美国又获得加速批准用于治疗转移性尿路上皮癌患者。随着FDA的批准,戈沙妥珠单抗(Trodelvy)在亚洲的大中华区、韩国、新加坡等国家和地区,也进行了申报审批。
戈沙妥珠单抗(Trodelvy)目前在市场上销售的主要有三个版本,分别为欧洲版规格200mg/瓶;美国版180mg/瓶;新加坡版180mg/瓶。为此我们与戈沙妥珠单抗(Trodelvy)原研厂家进行了确认,其实两者的目标剂量是一样的,现在带大家一起来了解一下:
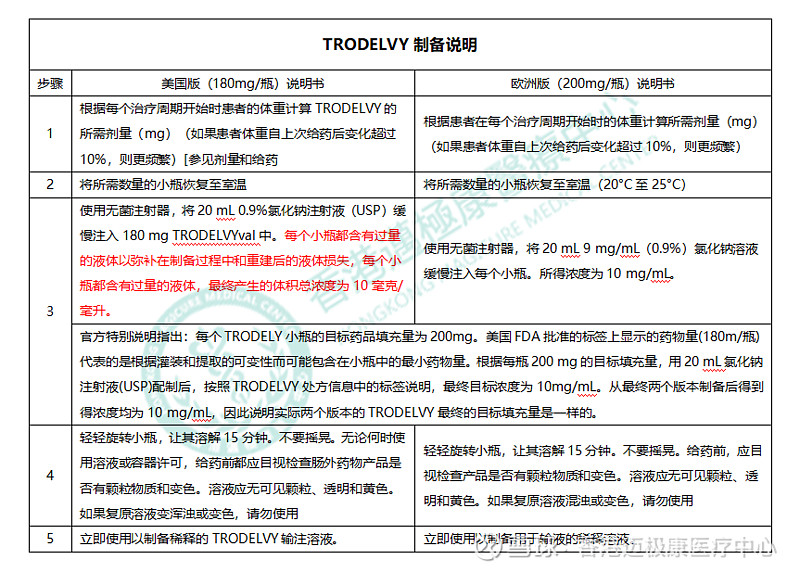
其中“180mg版戈沙妥珠单抗(Trodelvy)”制备说明中描述:使用无菌注射器,将20 mL 0.9%氯化钠注射液(USP)缓慢注入每180mg戈沙妥珠单抗(Trodelvy)小瓶。每个小瓶都含有过量的液体以弥补在制备过程中和重建后的液体损失,每个小瓶都含有过量的液体,最终产生的体积总浓度为10 mg/mL。
“200mg版戈沙妥珠单抗(Trodelvy)”制备说明中描述:使用无菌注射器,将20 mL的氯化钠9 mg/mL(0.9%)溶液缓慢注入每个小瓶中。所得浓度为10 mg/mL。
官方特别说明指出:每个TRODELY小瓶的目标药品填充量为200mg。美国FDA批准的标签上显示的药物量(180m/瓶)代表的是根据灌装和提取的可变性而可能包含在小瓶中的最小药物量。根据每瓶200 mg的目标填充量,用20 mL氯化钠注射液(USP)配制后,按照戈沙妥珠单抗(Trodelvy)处方信息中的标签说明,最终目标浓度为10mg/mL。从最终两个版本制备后得到得浓度均为10 mg/mL,因此说明实际两个版本的戈沙妥珠单抗(Trodelvy)最终的目标填充量是一样的。

2021年5月18日,中国国家药监局药品审评中心(CDE)受理了戈沙妥组单抗的上市申请,该申请随后以“符合附条件批准的药品”为由被纳入优先审评,拟用于治疗接受过至少2线既往治疗的转移性TNBC成人患者。申请规格为180mg/瓶规格的Trodelvy。
2022年2月7日公布新加坡卫生科学局(HSA)已批准Trodelvy®(戈沙妥珠单抗)用于治疗既往接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。吉利德厂家在亚洲的新加坡推出的上市版本是180mg/瓶规格的Trodelvy。
2022年6月10日中国国家药品监督管理局(NMPA)批准Trodelvy®(戈沙妥珠单抗,中文名拓达维®)用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者,很快Trodelvy也会在中国市场上销售,相信将参照新加坡已上市的180mg/瓶规格。
2023年2月3日美国食品和药物管理局(FDA)批准Trodelvy(sacituzumab govitecan-hziy)用于治疗无法切除(不符合手术切除条件)的局部晚期或转移性(扩散到身体其他部位)激素受体(HR)患者-阳性、HER2阴性乳腺癌。未来戈沙妥珠单抗(Trodelvy)将为更多肿瘤患者带来福音。
免责说明:香港迈极康医疗内容团队专注介绍传播最新医药学术资讯。本文仅作信息交流之目的,文中观点不代表香港迈极康立场,亦不代表香港迈极康支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往迈极康线下医疗中心。
版权说明:本文来自香港迈极康内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「香港邁極康醫療中心」微信公众号回复“转载”,获取转载须知。