2023年03月02日讯 / 香港迈极康hkmagicure / -- 2月28日,再生元(Regeneron)和赛诺菲(Sanofi)宣布,美国FDA已批准Kevzara(sarilumab)用于治疗风湿性多肌痛(PMR),这是一种炎症性风湿病,适用于对皮质类固醇(CS)反应不足或不能耐受皮质类固醇减量的成年患者。新闻稿指出,这是首款也是唯一一款获美国FDA批准治疗该疾病的生物制剂。

FDA批准Kevzara的这一额外适应症是基于SAPHYR 3期随机临床试验的结果,该试验是在类固醇耐药的活动性PMR患者中进行的,这些患者在减量期间服用≥7.5 mg/天的泼尼松或等效药物。在该试验中,患者被随机分配接受每两周一次200毫克Kevzara以及14周逐渐减量的CS(n=60;1名患者被随机分配但未接受治疗)或每两周一次安慰剂以及52周减量CS(n=58)。
试验结果显示,在52周时,该试验达到了其主要终点,接受Kevzara治疗的患者中有28%实现了持续缓解,而安慰剂组为10%(p=0.0193)。持续缓解被定义为在第12周时疾病缓解,没有疾病发作,第12周至第52周C反应蛋白正常化,以及从第12周至第52周遵守CS减量方案。
去除急性期反应物(持续炎症的测量)的敏感性分析保持显着性(Kevzara与安慰剂的比例差异:18%;95%置信区间:3.1至32.6)并确认了主要结果。此外,对次要终点的分析显示,Kevzara的中位累积CS剂量为777毫克,而安慰剂为2044毫克。
Kevzara(sarilumab)由再生元和赛诺菲根据全球合作协议共同开发。Kevzara是采用Regeneron公司专有的VelocImmune技术发明的,它与IL-6受体特异性结合,并已被证明可以抑制IL-6介导的信号传导。IL-6是一种免疫系统蛋白,在类风湿性关节炎患者中产生量增加,并与疾病活动、关节破坏和其他系统性问题有关。除了PMR之外,Kevzara在多个国家还被批准用于治疗对既往治疗无反应或无法耐受的中度至重度活动性类风湿性关节炎(RA)成人患者。
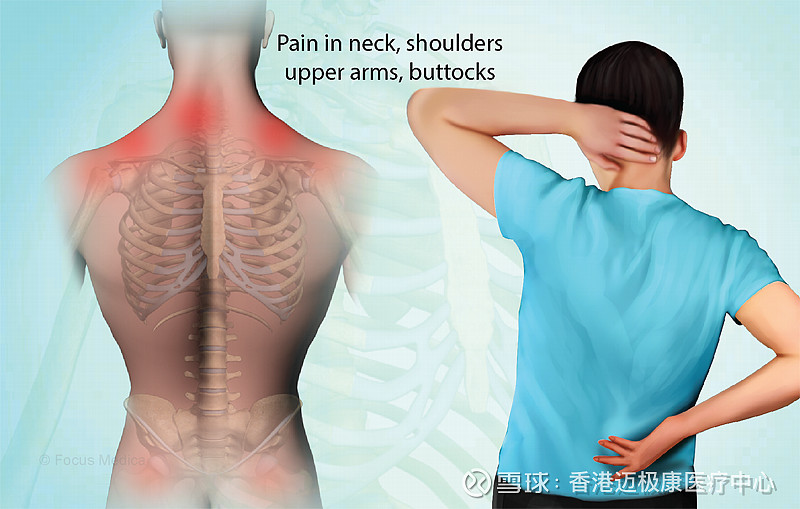
风湿性多肌痛(PMR)通常最初表现为颈部、肩部和臀部周围的疼痛和僵硬,症状包括疲劳、低烧和体重减轻。患者经常在皮质类固醇(CS)治疗停止后逐渐减量或复发期间出现耀斑。PMR患者报告难以执行日常功能,例如起床、从椅子上站起来或举起手臂。PMR通常会影响50岁及以上的人。
“风湿性多肌痛可能是一种致残性疾病,会在身体的多个部位引起疼痛性疾病发作,使人们感到疲劳,无法充分进行日常活动。到目前为止,皮质类固醇一直是主要的治疗方法,但许多患者对类固醇没有充分的反应,或者不能逐渐减少使用类固醇,这使这些患者面临长期类固醇治疗并发症的风险,”Regeneron总裁兼首席科学官George D.Yancopoulos医学博士说。“随着Kevzara治疗风湿性多肌痛的批准,患者现在有了FDA批准的治疗方法,以帮助缓解这种疾病的致残症状和对类固醇的长期依赖。”
版权/免责说明:本文来自香港迈极康医疗内容团队,欢迎个人转发至朋友圈。香港迈极康医疗内容团队专注介绍传播最新医药学术资讯。本文仅作信息交流之目的,文中观点不代表香港迈极康立场,亦不代表香港迈极康支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。