2023年02月23日讯 / 香港迈极康hkmagicure / -- 2月22日,阿斯利康(AstraZeneca)宣布其BTK抑制剂Calquence(acalabrutinib)片剂获得欧盟(EU)批准,用于治疗成人慢性淋巴细胞白血病(CLL)患者。欧盟委员会的批准遵循了人用药品委员会的积极意见,并基于美国血液学会期刊《血液》上发表的ELEVATE-PLUS试验结果。

慢性淋巴细胞白血病(CLL)成年人中最常见的白血病类型,2019年全球新增病例超过10万例。尽管一些CLL患者在诊断时可能不会出现任何症状,但其他人可能会出现症状,如虚弱、疲劳、体重减轻、寒战、发烧、盗汗、淋巴结肿大和腹痛。在CLL中,骨髓、血液和淋巴结中存在异常淋巴细胞的积聚。随着异常细胞数量的增加,骨髓中产生正常白细胞、红细胞和血小板的空间越来越小。这可能导致贫血、感染和出血。通过BTK的B细胞受体信号传导是CLL的重要生长途径之一。
Calquence(acalabrutinib)是下一代选择性布鲁顿酪氨酸激酶(BTK)抑制剂。Calsequence与BTK共价结合,从而抑制其活性。在B细胞中,BTK信号通路导致B细胞增殖、运输、趋化和粘附所必需的通路的激活。Caleque在欧盟被批准为CLL的胶囊制剂。它在美国也被批准作为CLL、小淋巴细胞淋巴瘤(SLL)和复发或难治性套细胞淋巴瘤(MCL)患者的胶囊和片剂制剂。此外,Caleque在世界许多其他国家被批准为胶囊制剂。

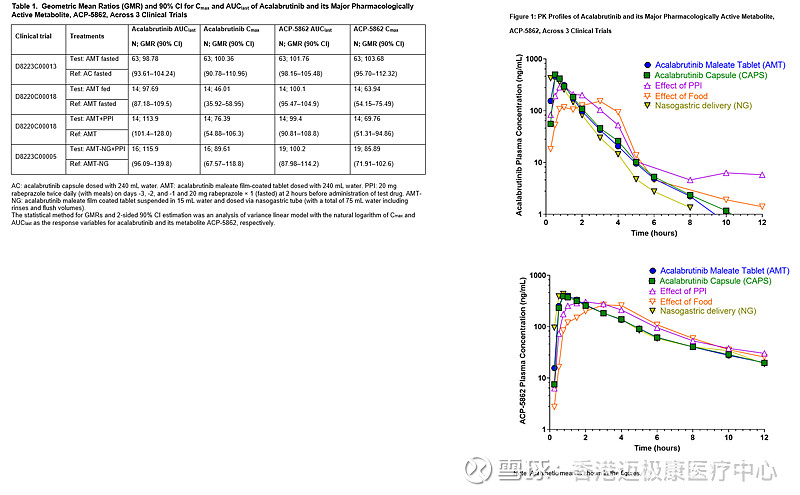
ELEVATE-PLUS由三项I期、开放标签、单剂量、交叉研究组成,对116名健康受试者进行了研究。该试验确定了acalabrutinib片剂(100mg)和acalabrutinib胶囊(100mg)之间的生物等效性,评估了acalabrutinib片剂在PPI雷贝拉唑存在与不存在的情况下的PPI效应,并通过比较acalabrutinib片剂在高脂肪饮食和禁食时的食物效应。
在试验中,结果显示Calquete胶囊和片剂制剂具有生物等效性,表明在相同的给药强度和时间表下,可以预期具有相同的疗效和安全性。片剂可与胃酸还原剂一起服用,包括质子泵抑制剂(PPIs)、抗酸剂和H2受体拮抗剂(H2RA)。这些研究中观察到的大多数不良事件(AE)都是轻微的,没有发现新的安全问题。
阿斯利康肿瘤事业部执行副总裁Dave Fredrickson表示:“Calquence片剂配方强调了我们致力于了解慢性淋巴细胞白血病社区的需求,并提供以患者为导向的治疗解决方案。今天的批准为欧盟的医生和患者提供了更大的灵活性,以确定正确的治疗方案,并使更多的患者能够从这种药物中受益。”
版权/免责说明:本文来自香港迈极康医疗内容团队,欢迎个人转发至朋友圈。香港迈极康医疗内容团队专注介绍传播最新医药学术资讯。本文仅作信息交流之目的,文中观点不代表香港迈极康立场,亦不代表香港迈极康支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。