2022年12月30日讯/香港迈极康hkmagicure/--MediWound公司2022年12月29日宣布,美国食品药品监督管理局 (FDA) 已批准NexoBrid (anacaulase-bcdb) 用于去除部分皮层和/或全层深度热烧伤成人的焦痂。

FDA 对 NexoBrid 的批准是基于多项临床前和临床研究,包括关键性3期美国临床研究 (DETECT),该研究评估了 NexoBrid 在3%-30%总体表面积 (TBSA) 的部分皮层和全皮层深度热烧伤成人患者中的应用。该研究符合其完全去痂的主要终点以及所有次要终点,包括与标准治疗 (SOC)(包括手术和非手术去痂方法)相比,去痂时间更短,手术去痂发生率更低。还达到了关键安全性终点,即与使用 SOC 治疗的患者相比,在至伤口闭合 > 95%的时间方面具有非劣效性。
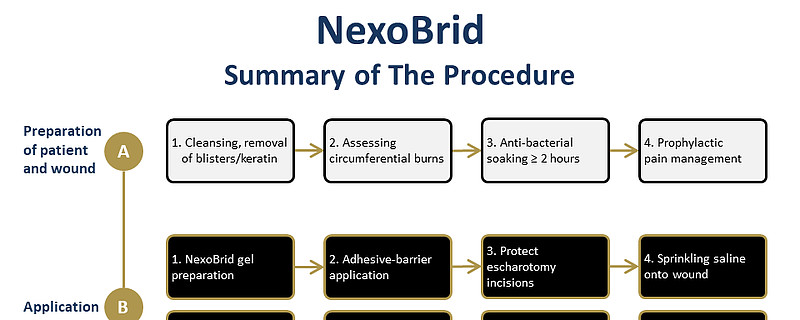
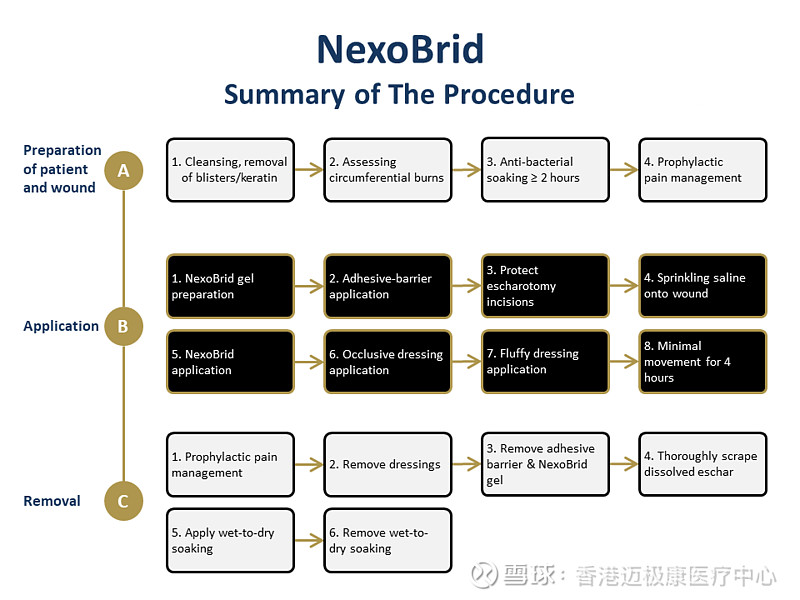
NexoBrid 最多可应用2次,每次4小时。首次应用 NexoBrid 可应用于高达15%体表面积的区域。第二次应用 NexoBrid 可在24小时后应用,两次应用的总治疗面积高达20%TBSA。
马萨诸塞州总医院医学博士 Jeremy Goverman 说:“在治疗部分和全层烧伤时,关键的第一步是快速清除焦痂,我相信 NexoBrid 的批准为我们提供了一种重要的非手术选择来快速有效地治疗严重的热烧伤。”“作为3期 DETECT 临床试验的主要研究者,我期待将 NexoBrid 进一步纳入实践中,因为我相信这将改善我的患者的结局。”

关于NexoBrid(anacaulase-bcdb)
NexoBrid(anacaulase-bcdb)富含菠萝蛋白酶的蛋白水解酶浓缩物 是一种局部给药的生物制品,可在应用后四小时内酶促去除深度局部和全层热烧伤患者的无活性烧伤组织或焦痂,而不会伤害有活力的组织。
NexoBrid 在 43 个国家、欧盟和其他国际市场获得批准。NexoBrid 在美国、欧盟等国际市场已被指定为孤儿生物药。NexoBrid是 MediWound Ltd. 的注册商标。Vericel 持有 NexoBrid 的北美商业权利的独家许可。

2022年12月23日日本厚生劳动省 (MHLW) 已授予NexoBrid上市许可,用于成人和儿童人群的非手术焦痂去除深度局部和全层热烧伤。
欧洲药品管理局( EMA )已经验证了 MediWound 提交的 II 型变体以供审查,以便将 NexoBrid 目前批准的适应症扩展到儿科人群。MediWound 预计欧盟委员会将在 2023 年第一季度做出决定。该研究达到了具有高度统计意义的三个主要终点。NexoBrid 证明完全去除焦痂的时间显着减少,需要手术切除的伤口面积(手术需要)显着减少,同时证明在疤痕质量方面不劣于 SOC。
参考资料:MediWound Announces FDA Approval of NexoBrid® for the Treatment of Severe Thermal Burns in Adults
版权/免责说明:本文来自香港迈极康医疗内容团队,欢迎个人转发至朋友圈。香港迈极康医疗内容团队专注介绍传播最新医药学术资讯。本文仅作信息交流之目的,文中观点不代表香港迈极康立场,亦不代表香港迈极康支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。