人体内存在多种形式的RNA,除了信使RNA(mRNA)可以表达为蛋白外,还存在多种非编码RNA(ncRNA)参与主要的基因表达调节、蛋白翻译等一系列重要的生理活动,直接影响着人体功能与健康(图1)。
RNA 可以形成不同的、复杂的结构,包括一级结构,二级结构(如发夹结构、茎环结构、螺旋结构等),三级结构(如多螺旋连接)和更为复杂的四级结构(如核糖体由多个RNA链条组成)。
RNA突变导致的RNA结构变异,会导致正常功能缺失或者是出现异常功能,这两种情况与多种疾病紧密相关,如心脏疾病、炎症、神经类疾病以及癌症等1。
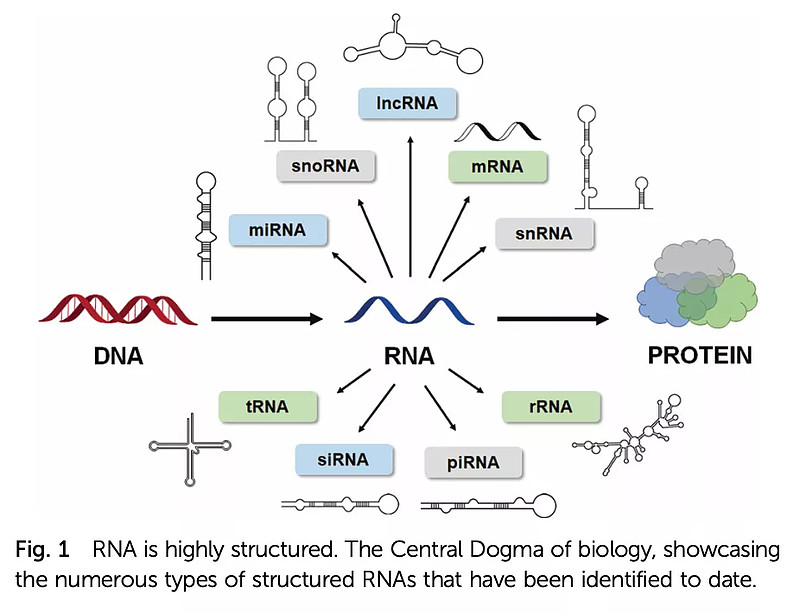
图1. RNA在生物体内具有多种形态与结构1
RNA作为药物靶点可以拓展蛋白质作为靶点的局限
1)由于RNA处于蛋白质的上游,靶向RNA有望直接对蛋白质的翻译效率进行上调或下调,解决蛋白“不可成药”的难题;
2)人类的基因组中,只有1.5%的序列编码了蛋白质,和疾病相关的蛋白更是只占其中的10-15%,而现在获批的针对疾病相关蛋白的小分子药物只有0.05%。而RNA在人类基因组中极为丰富,产生非编码RNA的序列占到了基因组的70%,丰度比编码蛋白质的序列高出一个数量级,而现在非编码中的miRNA已经被验证为具备临床治疗价值的药物靶点2(图2)。
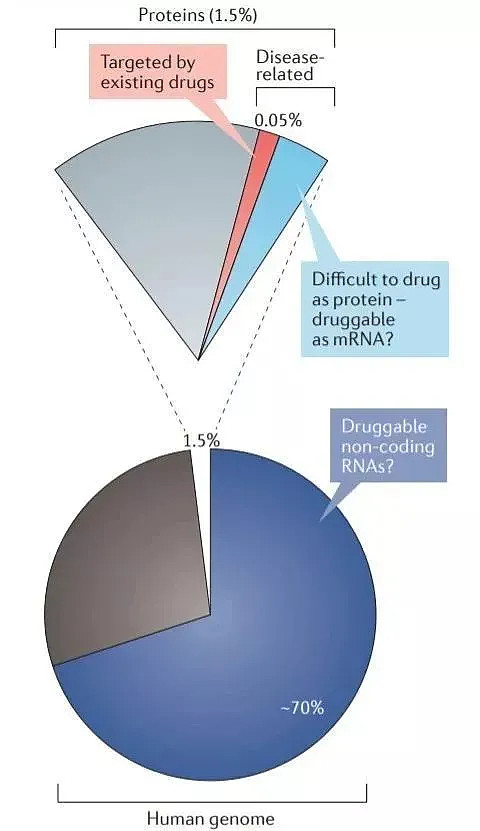
图2. 相对于蛋白靶点,信使RNA和非编码RNA存在大量潜在的药物靶点3
针对RNA的药物分为两类,一类是核酸药物,如RNA疫苗、ASO、siRNA、saRNA等,已经有多家生物科技和药物开发公司布局(如BioNTech、Moderna、Ionis、Alnylam等)并有多个上市及进入临床药物。
但是这类核酸药物面临一些局限,包括体内的递送系统组织选择性有限、生产及质控难度较大、载体可能产生一定细胞毒性等问题。
另一类治疗策略则是靶向RNA的小分子药物。85%的RNA会折叠成二级和三级结构,这些复杂的结构可能形成可以供小分子结合的“口袋”。通过靶向RNA的结构,从而影响RNA的功能。
而小分子药物相对于核酸药物具备成药性较好,如可口服、生物利用度高、组织分布、免疫原性低、药代动力学和药物分布等方面都更有优势4。另外小分子药物的研发、临床审批、生产到销售的链条都已非常成熟,因此后续产业化发展的不确定性较小。
以小分子形式的靶向RNA药物具有独特优势
2020年美国FDA批准了Risdiplam针对脊髓性肌萎缩症(spinal muscular atrophy,SMA)治疗药物的上市,此举直接将小分子、ASO、以及基因治疗这三种治疗类型放在市场上同台竞争。
SMA是常染色体隐性遗传疾病,发病原因是由于位于五号染色体长臂的运动神经元存活基因1(survival motor neuron gene 1, SMN1)出现缺陷或缺失,该缺陷影响剪接体组合和信使RNA的翻译,从而导致SMN蛋白功能缺陷所致的遗传性神经肌肉病。
SMA患者脊髓前角运动神经元退化变性和丢失,会导致肌无力,骨骼肌萎缩,肢体麻痹,呼吸衰竭和死亡。每6000-10000个新生儿就有一个患病,是婴儿期最常见的致死性疾病。其中,中国的SMA患者约3万人5。
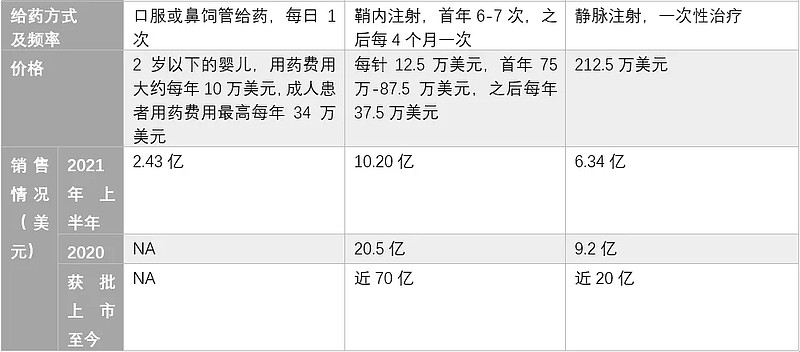
市面上批准了三款治疗SMA的药物,一款为2016年获得FDA上市批准的,Ionis开发的药物Spinraza(nusinersen),为全球首个治疗SMA的药物。该药是一种反义寡核苷酸(ASO),通过与SMN2基因的前体mRNA结合,促进其7号外显子编入成熟mRNA中,产生功能类似SMN1的蛋白。但是需要通过鞘内注射给药,将药物直接递送至脊髓周围的脑脊液(CSF),并且第一年需给药6次。
另外是2019年5月,来自诺华的基因疗法Zolgensma(onasemnogene abeparvovec)获得FDA批准上市,成为全球首个治疗SMA的基因疗法。Zolgensma利用腺相关病毒(AAV)载体递送SMN1基因至脊髓运动神经元,从而提升具有完整功能的SMN蛋白表达量,进而治愈疾病。该药通过一次性静脉输注后持续表达SMN蛋白来阻止疾病进程,可解决SMA的根本病因,有望长期改善患者生存质量。但是治疗费用高达200万美金,且病毒载体的潜在安全性还需进一步数据验证。
2020年,美国FDA批准了ROCHE 和PTC therapeutics研发的Risdiplam上市,使其成为治疗所有类型SMA(1型、2型、3型)的首个口服药物。Risdiplam是一个针对SMN2的RNA剪接修饰的小分子药物(机理与Spinraza类似),旨在持续增加和维持中枢神经系统和外周组织中的SMN蛋白水平。Risdiplam在为期一年的临床研究中展示了良好的运动和生存率的改善:
有29%的婴儿(12/41,p<0.0001)在治疗第12个月可以无支撑坐立至少5秒钟。在1型SMA的自然发育史中,没有婴儿能够达到这一里程碑。
此外,根据哈默史密斯婴儿神经系统检查-2(HINE-2)的测量结果,18例(43.9%)婴儿能够保持头部直立、13例(31.7%)婴儿能够侧滚、2例(4.9%)婴儿能够在支撑下站立。
中位治疗持续时间为15.2个月,中位年龄为20.7个月。93%(38/41)的婴儿存活,85.4%(35/41)的婴儿无事件发生。自然史队列中,在未经治疗的情况下,发生死亡或永久性通气的中位年龄为13.5个月。
安全性方面,Risdiplam的不良反应也是可控的:常见的不良反应是发热、腹泻和皮疹。其中3名婴儿在治疗的头三个月内经历了致命的并发症,这些都被调查者认为与risdiplam无关6。

*根据180例的自然队列数据, 患者不可坐立,只有25%的婴儿在14个月大以后预计能够在没有永久性通气的情况下存活。
表1. 针对SMA的三种上市药物对比 (奇迹之光根据公开数据整理统计)
由于临床数据尚不足够以及临床设计方案的不同,因此尚不可以头对头的直接对比三类治疗方式。但是根据现有的临床试验数据,有机构表示靶向RNA的小分子Risdiplam和基因治疗的疗效相当,比直接作用于RNA的ASO药物疗效要好7。
在安全性方面,小分子药物的表现也更加出色,没有严重的器官副作用。另外也没有病毒载体以及核酸药物载体带来的潜在安全性问题。另外小分子药物还有多种优势:可以口服,给药方便;能够穿透血脑屏障,同时提高中枢和外周SMN蛋白水平,且蛋白水平稳定;生产方面成本便宜,可大规模生产等。
德国卫生技术评估机构 — 医疗质量与效率研究所(IQWiG)也对小分子的口服给药方式的益处给了肯定,机构表示对于患有 1 型 SMA 的儿童,与 Spinraza 相比,Risdiplam 有不可量化的益处,主要在于“消除”了Spinraza重复注射到椎管内的风险。
从销售来看,最早上市的Spinraza销售仍然领先,但是罗氏公司称Risdiplam在2021年第一季度中,在美国市场上表现出了强劲的渗透速度。因此,三种类型治疗药物在市场上的表现孰强孰弱有待验证,而Risdiplam对比Spinraza是否能青出于蓝而胜于蓝,未来可期。
靶向RNA的小分子药物吸引多家药企布局
由于核酸药物的火热,靶向RNA的小分子药物也吸引了多家初创公司布局,一些大型制药公司如罗氏、Biogen、BMS等早已纷涌而至(表2)。
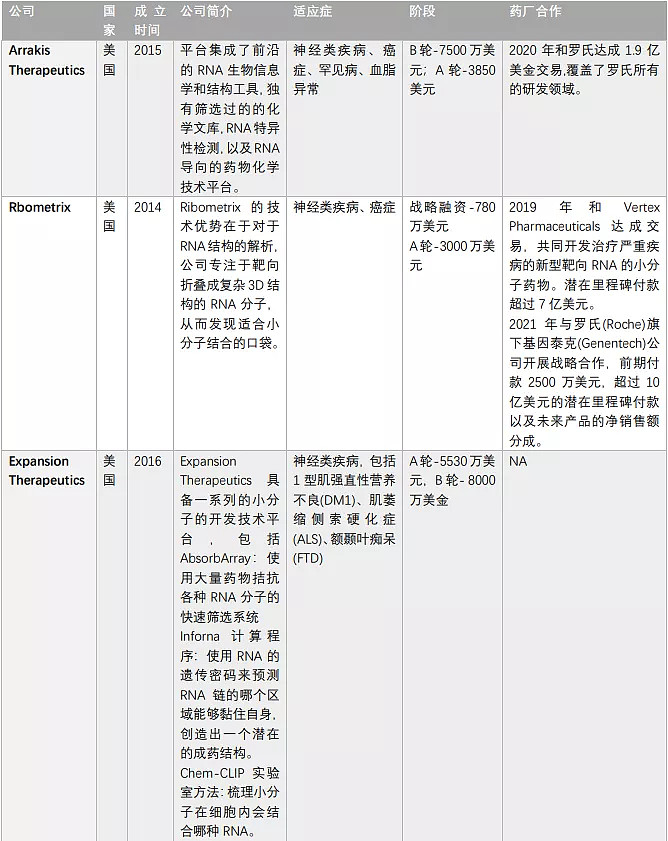
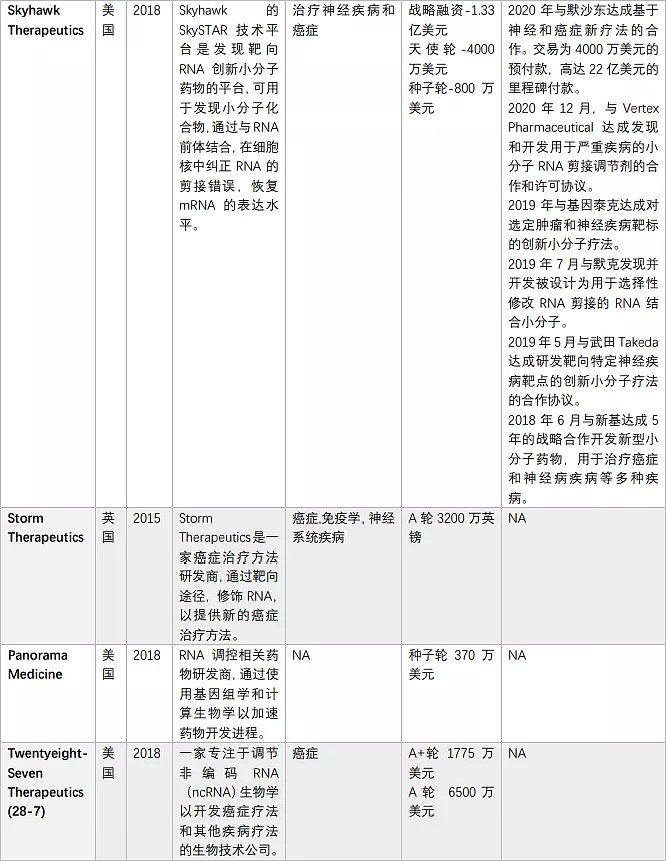
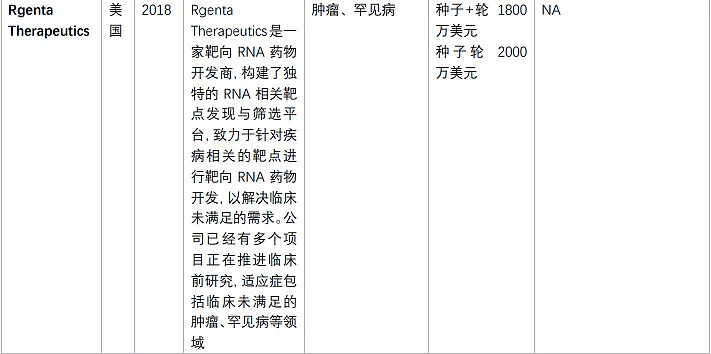
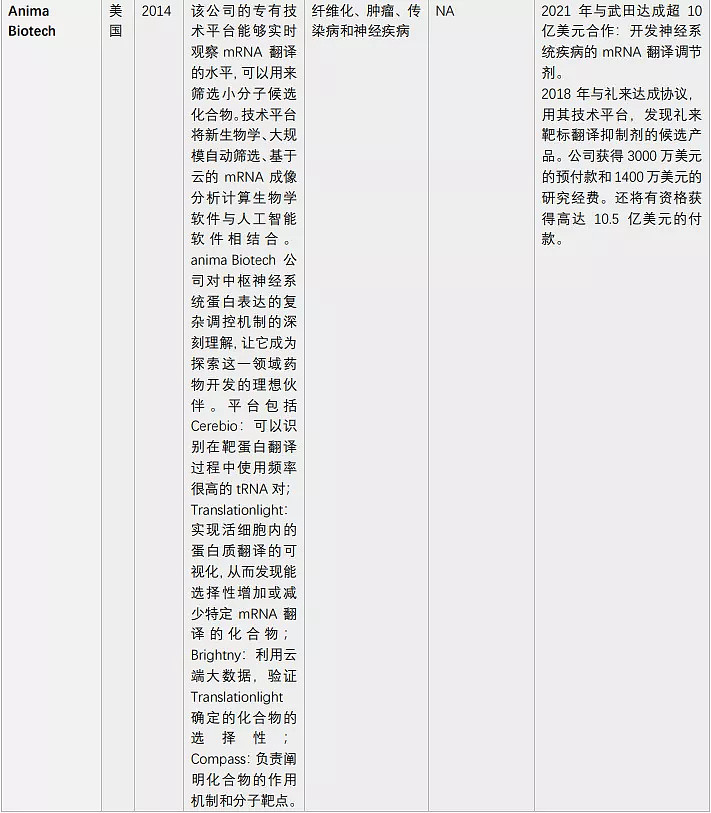
表2. 布局靶向RNA的小分子药物的公司(奇迹之光分析整理)
靶向RNA的小分子的现有技术及开发难点
最早发现的靶向RNA,并已经临床使用的小分子为以利奈唑胺(linezolid)为代表的氨基糖苷类抗生素,主要靶向细菌的核糖体RNA(由于细菌和人体的RNA序列及结构会有较大的不同,因此特异度在一定程度上较好实现)。
后续发现这类分子也会绑定到非核糖体RNA, 主要是由于带正电的核糖体会被大带负电荷的RNA吸引,带来非特异性的结合。但是这类结构都是从表型筛选找到的或者是随机发现,到后期才发现机理是通过靶向RNA。因此,行业需要建立一个可以基于RNA序列及结构系统性寻找小分子的技术平台。
要建立筛选平台,需要具备3个条件3:
(1)需要找到和疾病相关的RNA靶点
(2)通过高通量筛选寻找可以和RNA结合的分子
(3)找到在RNA上面的结构模体(motif),可以让小分子高亲和力和高特异性的进行绑定
现在对于第一个和第二个的研究相对比较多。比如针对第二点的小分子结合RNA的筛选方法包括高通量筛选、受结构启发的设计、基于片段的筛选方法、以及计算机模型等。一些基于结合的高通量筛选方法见图3。
图3. 部分靶向RNA的小分子高通量筛选方法
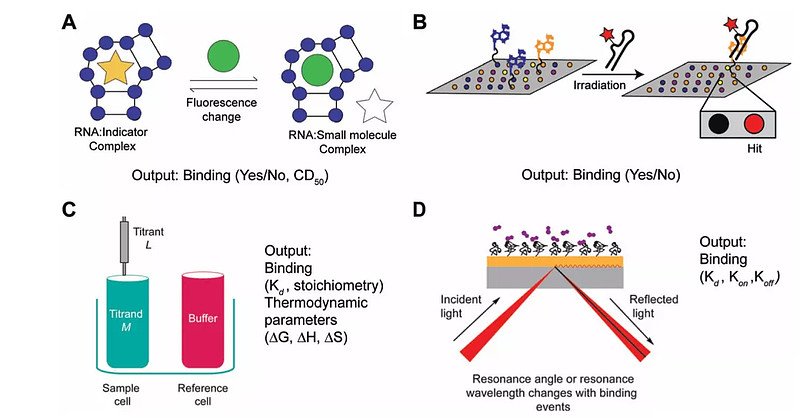
A.荧光指示剂置换分析检测(Fluorescence Indicator Displacement,FID),通过小分子结合导致的指示剂荧光强度的变化检测是否有小分子和RNA的结合。
B. 小分子微阵列(SMM)能够在辐照微阵列板时检测荧光阱,从而检测结合。该培养板含有固定化小分子配体,并在辐照前与荧光标记的RNA结构一起孵育;
C. 等温滴定量热法(ITC)- 通过直接测量小分子(滴定剂)结合到RNA结构(样品细胞)相对于缓冲液(参考细胞)的热变化来检测是否有结合。
D. 表面等离子体激元共振(SPR)直接测量加入小分子后含有固定化RNA的玻璃表面共振角或波长的变化
但是这些基于表型的筛选方法,得到的分子在成药性、结合的亲和力方面,以及结合后是否有真实的功能方面都有缺陷3。因此,行业还需要寻找可结合RNA的模体。这个难点主要包括但不限于以下几点:
一、由于RNA由四个核苷酸模块组成,因此与20种不同氨基酸组装的蛋白质相比,RNA序列看起来更相似。这使得发现选择性药物——结合单一类型的RNA且没有广泛的副作用更困难。
二、RNA的结构总是在摆动和变化,因此对于在不同环境下,识别RNA是处于什么状态和结构变得非常困难。
三、已知的RNA的结构还比较少,对于从RNA序列预测结构还需要更多的科研积累。
现有的寻找RNA模体区域也有一些方法。2018年nature review 的文献总结了现有在临床上使用的,靶向RNA的小分子结构为linezolid, ribocil, branaplam and SMA-C5, 每种结构都结合一种不同的RNA的结合区域的结构,代表了现在具备活性的靶向RNA小分子结构的初步金标准“gold standard”3(图4)。
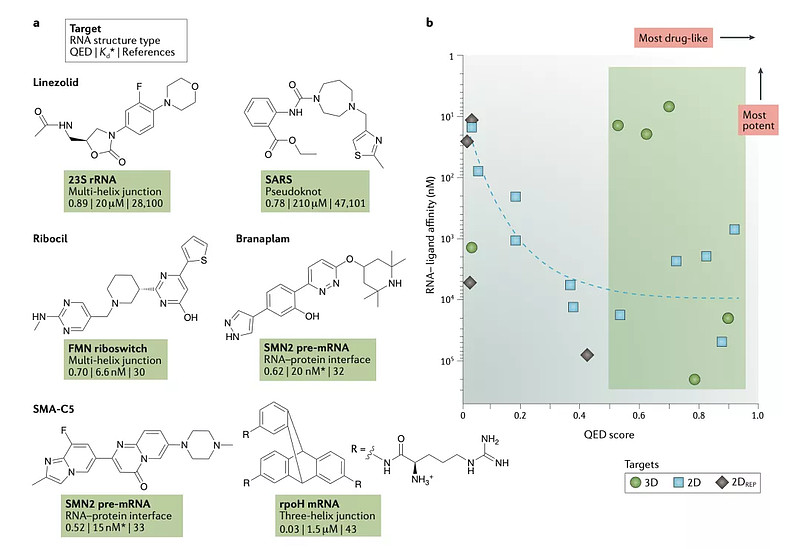
图4. 临床上已知的靶向RNA的小分子结构以及靶向的RNA类3
这些化合物和其与RNA结合的结构以及功能等相关数据积累后,将形成针对RNA特定结构为靶点的小分子药物库,就如现在的针对蛋白质为靶点的药物库。这样的方式可以提高找到活性分子的概率和成功率, 并且也可以找到除了结合2级结构以外更复杂结构的小分子。
总结
综上所述,靶向RNA的小分子药物已被证实可成药,现有上市药物具备较高的临床价值,对比同样作用于RNA的核酸药物(如ASO, siRNA), 在成药性、生产、给药途径等多方面更具优势。随着二代测序技术的发展,转录组数据的不断积累,以及对于RNA结构的理解加深,靶向RNA小分子的系统性开发将指日可待。