
2018年,《战略性新兴产业分类(2018)》发布,将生物医药产业列为国家战略性新兴产业,此后生物医药行业进入了一个新的爆发式增长阶段。根据《2019中国生命科学与生物技术发展报告》数据,2018年我国生物医药行业市场规模已超过3500亿元。
在生物医药行业快速发展之际,国内药品监管和审评标准也在经历一系列提升改革,以加快药品审评审批流程、提高药品质量。而不断提高的质量要求和降本增效的目标也拉动了创新药企外包服务需求的增加,CDMO成为市场和资本关注的热点领域。此外,随着2018年《关于组织实施生物医药合同研发和生产服务平台建设专项的通知》的下发,医药研发外包和生产外包服务得到进一步发展。CDMO成为医药产业链中不可或缺的重要一环,与CDMO合作,成为创新药企提升研发效率、降低生产成本、控制风险的重要策略。
在此背景下,一家致力于成为最受客户信任、全球领先的制药CDMO企业——北京昭衍生物技术有限公司(以下简称“昭衍生物”)应运而生。
昭衍生物,成立于2018年,由国内CRO龙头企业北京昭衍新药研究中心股份有限公司(以下简称“昭衍新药”)孵化,拓展和延伸服务业务版块的CDMO企业。依托核心团队丰富的行业经验和项目经验,昭衍生物目前在中美两地构建了两大研发生产基地,可为全球创新药研发机构提供可开发性研究、工艺放大优化、质量研究、中试及商业化生产等一站式生物药CDMO解决方案。
借鉴昭衍新药的服务理念和服务意识,核心团队拥有20余年行业经验
昭衍生物的创立源于昭衍新药生物药客户需求的推动。
作为一家成立于1995年的专业化CRO企业,昭衍新药凭借其在近30年发展中积累的丰富经验和行业口碑,承接了大量的客户订单。而不断增多的订单数量也为昭衍新药带来了新的“烦恼”:在客户排到实验时间的时候,样品却未能及时生产出来。
因此,为了响应生物药客户需求,为合作伙伴们提供更多生物药CDMO服务,综合考虑CDMO业务发展特点、服务团队和技术人员的需求等因素后,团队决定成立昭衍生物,在已有业务的基础上,开展CDMO业务。
昭衍生物正式成立后,在短时间内快速完成了团队建设,并与国内外多家制药企业建立了合作关系。这背后,离不开核心创始团队的执掌和引领。
昭衍生物两位联合创始人耿树生博士和贺涛博士都已在生物医药领域积累了20余年的研究、开发和管理经验。
耿树生博士是一位经验丰富的研发者和创业者,在生物大分子药领域具有20余年的研究、开发和管理经验。耿博士曾主持并直接参与研发了近20个抗体药物,并将这些药物推动至不同阶段临床试验,涉及肿瘤、感染、免疫治疗等多个领域。此外,耿博士在细胞系构建、工艺优化放大等领域亦具有丰富经验,主持并参与了10多项国家及市级科技专项课题的研究。
贺涛博士在蛋白质/单抗创新药物发现与开发领域拥有超过20年的经验,曾在诺华、惠氏和辉瑞等国际知名企业担任重要职务。作为团队负责人,贺博士曾领导并直接参与了多个成功获批临床或上市的生物大分子药物开发工作,是大分子候选药物可开发性研究、药物表征分析等方面的资深专家。
此外,昭衍生物还吸引了抗体、疫苗、重组蛋白等领域的资深专家加入,目前已拥有一支超500人具有丰富行业经验、熟悉中外新药法规的核心技术团队。
其中,研发副总赵健博士在抗体、重组蛋白、蛋白疫苗等领域拥有10余年的工作经验,领导和参与了多个抗体生物类似药、创新抗体药物以及重组疫苗药物的开发和研究工作,其中多个药物已成功获批临床或上市。生产VP刘冬连具有近30年生物药工艺开发和商业化生产经验,主持完成多个重组蛋白、病毒疫苗、单抗及ADC药物的研发和商业化生产,并具有商业化厂房建设和运营的经验,其创立的PB-Hybrid Technology细胞扩增技术已广泛用于抗体的商业化生产。
3.4万升产能已建成投产,拥有3个可商业化生产授权的宿主细胞
目前,昭衍生物中美两地研发生产基地已建成并投入商用,现有总产能达3.4万升,未来商业化总产能可达10万升。
昭衍生物在美国已建成多个1000L、500L、200L规模的符合FDA GMP标准的生产车间;在北京已建成15个符合中国、美国、欧盟以及WHO等国际化标准的2000L一次性大分子原液生产线,以及冻干、水针、预充针等多种剂型的高端制剂车间。同时,公司也已拥有50L—5000L各型反应釜,能够满足复杂工况产品的中商业批原料药生产需要。
依托两大研发生产基地,昭衍生物能够为全球创新药研发机构提供可开发性研究、工艺放大优化、质量研究、中试及商业化生产一站式解决方案。
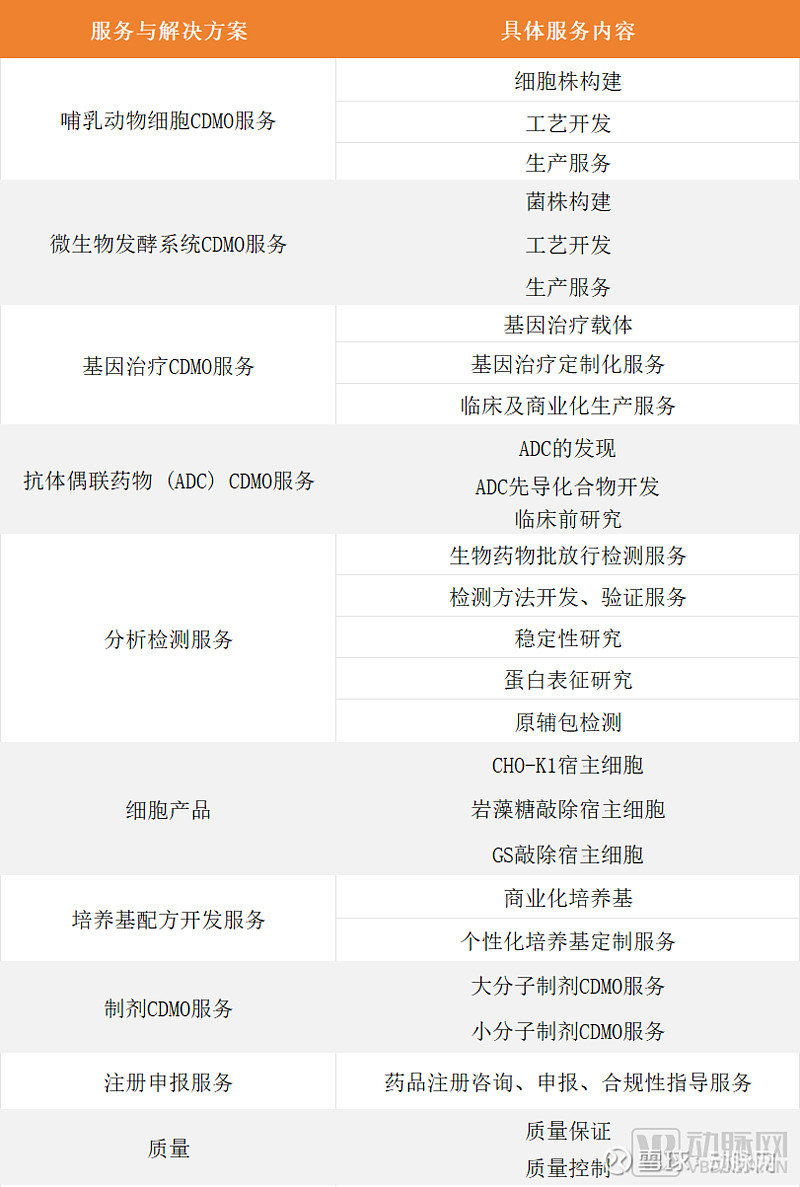
昭衍生物提供的服务与解决方案 图源:根据昭衍生物资料,动脉网制图
其中,昭衍生物的分析检测服务平台建设运行的检测实验室已顺利通过中国合格评定国家认可委员会(CNAS)的评审,获得CNAS实验室认可证书(注册号:CNAS L20078)。该平台拥有一支超100人的具有国际化专业经验的研究团队,可为药物开发全生命周期各环节提供完整的分析服务。
此外,对于制药公司而言,选择一个合适的CDMO合作伙伴十分关键,才能够真正帮助其提高效率、降低生产风险和成本。以抗体类药物的生产制造为例,其上游构建表达过程尤为重要,其中宿主细胞的选择极其重要,如若所委托的CDMO公司选择使用经其他机构授权甚至是没有知识产权的宿主细胞,有可能导致客户在后期的研发和生产中需要长期支付知识产权费用,甚至引发知识产权风险。
昭衍生物则能够帮助制药公司解决这一问题。公司技术团队在自主知识产权的CHO-K1基础上进行岩藻糖敲除,获得了完全无岩藻糖的宿主细胞,通过抗体表征及功能验证,得到了无岩藻糖的可应用于工业生产的细胞株CHO-K1-TGZ。
截至目前,昭衍生物共拥有三个具有完全知识产权的可用于中试和商业化生产的宿主细胞——CHO-K1、CHO-K1-去岩藻糖细胞株、CHO-K1 GS敲除细胞株,其来源清晰、表达量高,具有良好的表达稳定性和遗传稳定性,以及良好的价格竞争优势。
ADC生产线即将建成,持续强化细分赛道优势
近年来,CDMO公司数量不断增加,行业竞争日趋激烈。而今年开年以来,国内各大上市CDMO公司股价遭遇大跌。过去一年以来,CDMO行业发展可谓是“风雨飘摇”,频繁传出关厂、裁员等消息,各大CDMO公司正在加速行业调整。
尽管如此,昭衍生物依旧顺利地挺过了“资本寒冬”,并在激烈的市场竞争中占有一席之地。支撑昭衍生物越过周期的,正是过去5年来其在行业中积累的资质与合作经验,以及差异化优势和技术壁垒。最重要的是,昭衍生物具备“看得更远”的特质,能够根据市场发展提前布局,切入新兴领域,并优化自身在细分赛道的优势,以为不同领域客户提供专业、综合的一站式服务解决方案。
以ADC赛道为例,近两年ADC创新药研发热情高涨,诸多候选药物进入临床试验。根据弗若斯特沙利文公布的数据,自2018年以来,每年有15—57款ADC候选药物进入临床试验。截至2023年6月,全球有500多项正在进行的临床试验,涉及231款ADC候选药物。
ADC临床及临床前阶段管线外包服务需求也在持续增长。截至2022年底,全球ADC发现、开发及制造外包率已达到约70%,超过整体生物制剂的观察外包率34%。到2030年,全球ADC外包服务市场将大幅扩张,达到110亿美元,2022年—2030年的复合年增长率达28.4%。
面对火热的ADC外包服务市场,昭衍生物早已做好了准备。目前,昭衍生物可为全球客户提供ADC药物从分子发现到IND申报一站式研发和生产服务,包括ADC的发现、ADC先导化合物开发、临床前研究等。除此之外,昭衍生物正在持续建设ADC产能,其中,一个新的ADC的中试及商业化生产线即将于今年年底建成并正式投入使用。
已完成两轮超15亿元融资,未来加速产能扩增与国际化布局
凭借专业综合的一站式CDMO服务,昭衍生物获得了市场的认可与资本的青睐。目前,昭衍生物已为约300个大分子生物药项目提供了研发和生产服务,并在全球范围内获得30余个IND批件,已签约5个BLA项目。
此外,2019年12月,昭衍生物完成了6000万美元A轮融资;不到2年,公司在2021年8月再次宣布完成2亿美元B轮融资。至今,公司累计融资超15亿元,投资方包括CPE源峰、华盖资本、松禾资本、盈科资本、巢生资本、香港华联控股集团、香塘创投等。
目前,昭衍生物正在加快产能建设,将加快建设符合中国、美国及欧盟GMP标准的10万升规模原液和相关制剂生产线,并持续巩固提高团队的交付能力和技术能力,同时积极推进国际化市场布局,在完成已有项目的基础上,承接更多商业化项目订单。
未来,昭衍生物将继续拓展业务范围,把更多前沿生物药产品纳入其中,为更多不同领域的全球生物制药企业提供专业完整的服务和解决方案。
感谢海尔创投对本文的支持。
关于海尔创投
青岛海尔创业投资有限责任公司(简称“海尔创投”)成立于2010年,依托海尔产业背景坚持产业生态投资,设有母基金(品牌名:海创母基金)和直投基金,投向聚焦硬科技和大健康,目前投资覆盖项目400多个,专精特新等高科技企业占比超70%,已上市企业45家。海尔创投愿与生态伙伴一起,助力科技强国和健康中国战略,以基金培育产业生态圈,促进实体经济高质量发展,更好地服务提升人们的生活质量和生命质量。
近
期
推
荐



声明:动脉网所刊载内容之知识产权为动脉网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。
动脉网,未来医疗服务平台
