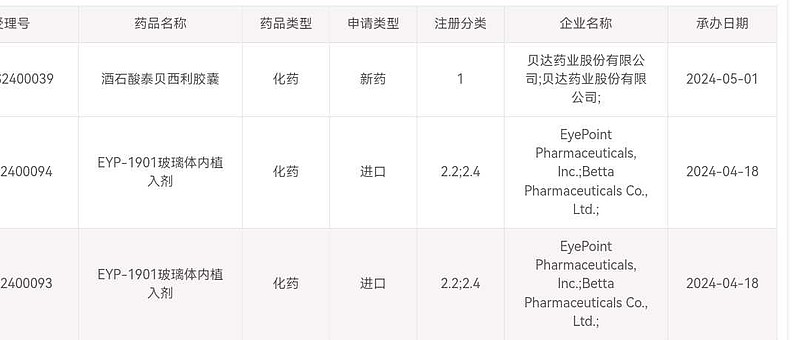

| 发布于: | Android | 转发:0 | 回复:12 | 喜欢:0 |

数据还没出。
创新药NDA(New Drug Application,新药上市许可申请)的审批时间是衡量药品监管能力和效率的重要指标。根据搜集到的信息,以下是中国创新药NDA审批时间的一些关键点:
1. **审批时间缩短**:自2015年药品监管制度改革以来,中国创新药NDA的审批时间有了显著缩短。2017-2021年新药申请批准时长的中位值为15.4个月,这是十年来最短的时长,明显短于改革前。
2. **优先审评影响**:优先审评(PR)和临床急需境外药品(UNOD)等加快审评审批程序显著缩短了NDA的批准时间。与标准审评相比,优先审评将NDA审批时间缩短为155个工作日。
3. **临床急需境外药品审批**:中国药品监管机构于2018年11月制定了临床急需境外药品的审批程序,这些药品的批准主要基于在其他国家产生的临床试验数据,具有快速批准的资格,技术审查时间为6个月,如为罕见病药品则为3个月。
4. **肿瘤药品审批**:肿瘤药品与较短的NDA获批时间相关。在优先审评的获批药品中,肿瘤药品的NDA获批时长在统计学上显著短于非肿瘤药品。
5. **进口药品与国产药品审批时长**:进口药品的NDA获批时长在不同时间段均短于国产药品,但在2017-2021年,国产和进口药品的NDA获批时长差距仅为2.2个月,显示国产药品审批时间缩短幅度更大。
6. **药品滞后问题**:尽管审批时间缩短,但在中国近年批准的新药中,仍存在约五年的“药品滞后”。这表明,尽管NDA审批流程本身并不是造成延误的主要因素,但其他因素如临床试验审批时间等可能起了重要作用。
7. **改革效果**:改革后,IND审批时间比改革前缩短了414天,NDA审批时间缩短了441天。这表明监管改革促进了本土医疗创新,并且审查审批改革是有益的。
8. **未来趋势**:中国药品审评审批改革在药品监管审批的几个指标上已产生了显著的积极效果。中国的药品监管体系还将继续发展,还有很多地方需要进一步地改革和完善。
这些信息表明,中国在创新药NDA审批方面取得了显著进步,缩短了审批时间,并实施了一系列措施以加快审批流程,尤其是在优先审评和临床急需境外药品审批方面。同时,也指出了“药品滞后”等问题,需要进一步的改革和完善。
还得看贝达准备的材料质量怎么样,会不会发补
BPI-16350去年上半年才完成入组,如今已提交NDA,进展神速,值得表扬,希望早日获批上市。
总体来看,这次的效率是比较高的,相比以前的确有了很大的进步。
已有资料看,三个月到一年半都有可能。
是不是25年6月30日之前通过,就能参与年底的国谈?