
要点:
GMP
冠昊生物:控股子公司获得《药品GMP证书》的公告
批件
康弘药业:获得药品阿立哌唑口服溶液注册批件
浙江海正: 获得药品琥珀酸索利那新片注册批件
恒瑞医药:获得注射用卡瑞利珠单抗(SHR-1210)临床试验通知书
投资
仙琚制药: 拟对卢森堡子公司进行增资
昆药集团:全资子公司昆明昆药血塞通药物研究有限公司股权转让
华大基因:参与投资设立产业投资基金的进展
一致性评价
复星医药: 控股子公司沈阳红旗药品异烟肼片通过仿制药一致性评价
中国医药:子公司药品盐酸二甲双胍缓释片通过仿制药一致性评价
报告分享:
埃森哲:人工智能应用之道(高管指南)(92p)

摄影:Merrick Bultruschat
第1部分:战略动向


GMP
证券代码:600085 证券简称:同仁堂 公告编号:临2019-018
北京同仁堂股份有限公司于近日获悉,子公司北京同仁堂科技发展股份有限公司所属制药厂经过现场检查和技术审核,符合《药品生产质量管理规范》要求,收到北京市药品监督管理局颁发的《药品GMP证书》。相关信息如下:
企业名称:北京同仁堂科技发展股份有限公司制药厂
生产地址:北京市大兴区青云店镇小谷店村西、北京市大兴区中关村科技园区大兴生物医药产业基地天贵大街26号、北京市大兴区中关村科技园区大兴生物医药产业基地天贵大街28号
证书编号:BJ20190432
认证范围:中药前处理、中药前处理、丸剂(蜜丸、水蜜丸)
发证日期:2019年7月8日
有效期至:2024年7月7日
冠昊生物:控股子公司获得《药品GMP证书》的公告
证券代码:300238 证券简称:冠昊生物 公告编号:2019-038
冠昊生物科技股份有限公司的控股子公司广东中昊药业有限公司于2019年7月19日收到广东省药品监督管理局颁发的《药品GMP证书》,现将相关情况公告如下:
企业名称:广东中昊药业有限公司
地址:广东省中山市火炬开发区华佗路1号;广东省中山市火炬开发区仲景路6号。
证书编号:GD20191026
认证范围:原料药(本维莫德,仅供自用),乳膏剂
有效期至:2024年7月17日
本次通过GMP认证并获得《药品GMP证书》,表明控股子公司生产车间符合国家法定要求,可以满足本维莫德乳膏的批量生产,将有利于提高控股子公司生产能力,更好的满足市场需求。
由于医药产品具有高科技、高风险、高附加值的特点,药品的投产及投产后的具体销售情况可能受到市场环境变化等因素影响,具有较大不确定性。敬请广大投资者谨慎决策,注意防范投资风险。
批件
康弘药业:获得药品阿立哌唑口服溶液注册批件
证券代码:002773 证券简称:康弘药业 公告编号:2019-056
成都康弘药业集团股份有限公司于近日收到国家药品监督管理局签发的关于阿立哌唑口服溶液的《药品注册批件》(批件号:2019S00438),具体情况如下:
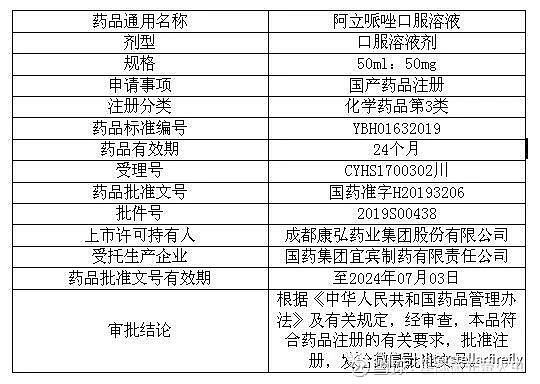
产品简介:
阿立哌唑作为新一代抗精神病药物,具有副作用小、疗效显著、复发率低等优点,适用于精神分裂症患者的长期维持治疗。阿立哌唑口服溶液属于按化学药品新注册分类批准的化学药品第3类,用于治疗精神分裂症。与片剂相比,口服溶液的相对优势在于低剂量或调整剂量更为方便,具有提高患者顺应性、解决吞咽困难等优点。经查询国家药品监督管理局药品数据库,截至目前,国内尚无其他企业获批阿立哌唑口服溶液,公司为国内首家获得阿立哌唑口服溶液生产批件的企业。
浙江海正: 获得药品琥珀酸索利那新片注册批件
股票简称:海正药业 股票代码:600267 公告编号:临2019-97号
近日,浙江海正药业股份有限公司收到国家药品监督管理局核准签发的琥珀酸索利那新片的《药品注册批件》。相关情况如下:
药品名称:琥珀酸索利那新片
剂型:片剂
规格:5mg
申请事项:国产药品注册
注册分类:化学药品第4类
申报阶段:生产
申请人:浙江海正药业股份有限公司
受理号:CYHS1700603浙
批件号:2019S00433
药品批准文号:国药准字H20193202
审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准注册,发给药品批准文号。
该药品其他相关情况:
琥珀酸索利那新片适用于膀胱过度活动症患者伴有的尿失禁和/或尿频、尿急症状的治疗。原研产品(商品名:Vesicare®)由荷兰Astellas Pharma Europe B.V.生产。目前,国内主要生产厂商有四川国为制药有限公司和齐鲁制药有限公司。
经查询IMS数据库,琥珀酸索利那新片2018年全球销售额为163,385.26万美元,其中中国销售额为583.42万美元;2019年1-3月全球销售额为37,601.69万美元,其中中国销售额为164.27万美元。
公司于2017年11月29日向浙江省药品监督管理局递交药品注册申请并获得受理。截至目前,公司在该药品研发项目已投入1,418万元人民币左右。
恒瑞医药:获得注射用卡瑞利珠单抗(SHR-1210)临床试验通知书
证券代码:600276 证券简称:恒瑞医药 公告编号:临2019-051
江苏恒瑞医药股份有限公司及子公司苏州盛迪亚生物医药有限公司、上海恒瑞医药有限公司近日收到国家药品监督管理局核准签发的《临床试验通知书》,并将于近期开展临床试验。相关情况如下:
药品名称:注射用卡瑞利珠单抗(SHR-1210)
剂型:注射剂
规格:200mg/瓶
申请事项:临床试验
申请人:江苏恒瑞医药股份有限公司、苏州盛迪亚生物医药有限公司、上海恒瑞医药有限公司
受理号及审批结论——
CXSL1900036:
根据《中华人民共和国药品管理法》及有关规定,经审查,2019年4月17日受理的注射用卡瑞利珠单抗符合药品注册的有关要求,同意按照提交的方案开展注射用卡瑞利珠单抗(SHR-1210)联合卡培他滨和奥沙利铂序贯卡瑞利珠单抗联合甲磺酸阿帕替尼治疗既往未接受过系统治疗的晚期或转移性胃癌(GC)或胃食管交界处癌(GEJ)的随机、开放性、多中心III期临床研究。
CXSL1900037:
根据《中华人民共和国药品管理法》及有关规定,经审查,2019年4月18日受理的注射用卡瑞利珠单抗符合药品注册的有关要求,同意按照提交的方案开展注射用卡瑞利珠单抗(SHR-1210)联合FOLFOX4对比安慰剂联合FOLFOX4一线治疗晚期肝细胞癌患者的随机、平行对照、双盲、多中心III期临床研究。
投资
仙琚制药: 拟对卢森堡子公司进行增资
证券代码:002332 证券简称:仙琚制药 公告编号:2019-026
anju Pharma Luxembourg S.A.R.L(仙琚制药卢森堡有限责任公司)为浙江仙琚制药股份有限公司设立在卢森堡的全资子公司,anju Pharma Italy S.R.L(仙琚制药意大利有限责任公司)为仙琚卢森堡公司设立在意大利的全资子公司。根据公司目前经营情况和未来发展需要,公司拟以货币出资方式向仙琚卢森堡公司增资13,000万美元(约合人民币89,389.3万元),后续仙琚卢森堡公司再向仙琚意大利公司增资。
本次增资事项已获公司第六届董事会第二十次会议审议通过,根据《公司章程》、公司《投资管理制度》规定,本次增资事项尚需提交公司2019年第一次临时股东大会审议批准。本次增资属于对全资子公司的投资,不构成关联交易,亦不构成《上市公司重大资产重组管理办法》规定的重大资产重组。本次增资以履行中国政府相关部门的备案程序为前提。
增资标的基本情况:
1、仙琚卢森堡公司
公司名称:
anju Pharma Luxembourg S.A.R.L
注册地址:
卢森堡大公国卢森堡市 Luxembourg, rue St-Hubert, 19号
注册登记号:B215793
注册资本:25万美元
注册日期:2017年6月29日
董事:徐衠、 LIN aoshan
主营业务:医药及医药中间体贸易
最近一年一期的主要财务数据为:
2018年度末总资产14,109.44万欧元、负债13,322.23万欧元、净资产787.21万欧元;2018年度营业收入7,248.14万欧元、净利润693.05万欧元。2019年3月末总资产14,464.40万欧元、负债13,562.79万欧元、净资产901.60万欧元;2019年1-3月营业收入1,676.58万欧元、净利润112.73万欧元。
(以上2018年度数据经审计,2019年1-3月数据未经审计)
2、仙琚意大利公司
公司名称:
anju Pharma Italy S.R.L
注册地址:
意大利 Milano Foro Buonaparte 20号
注册登记号:MI-2126826
注册资本:12.5万欧元
注册日期:2017年7月14日
董事:徐衠、张宇松、Carlo Cartasegna
主营业务:医药及医药中间体贸易
最近一年一期的主要财务数据为:
2018年度末总资产14,098.84万欧元、负债13,321.55万欧元、净资产777.29万欧元;2018年度营业收入7,248.14万欧元、净利润694.72万欧元。2019年3月末总资产14,453.79万欧元、负债13,562.11万欧元、净资产891.68万欧元;2019年1-3月营业收入1,676.58万欧元、净利润114.39万欧元。
(以上2018年度数据经审计,2019年1-3月数据未经审计)
昆药集团:全资子公司昆明昆药血塞通药物研究有限公司股权转让
证券代码:600422 证券简称:昆药集团 公告编号:2019-075号
为贯彻落实《中国制造2025》行动计划和执行《云南省制造业创新中心培育创建工作方案》的通知,公司拟将“昆明昆药血塞通药物研究有限公司”更名为“云南创新药物研究有限公司”,打造昆药集团云药制造业创新中心平台。
昆明血塞通系于2014年04月16日设立的有限责任公司,注册资本为1,000万元(认缴出资)。截至本公告日,公司持有昆明血塞通100%的股权,尚未实缴出资。经公司九届十三次董事会审议通过,公司将转让10%的股权给昆中药、转让10%的股权给贝克诺顿、转让10%的股权给版纳药业、转让5%的股权给昆商、转让4%的股权给禄丰县公司。股权转让后,公司将持有昆明血塞通61%的股权,以上各相关全资成员企业合计持有昆明血塞通39%的股权。昆中药、贝克诺顿、版纳药业、昆商和禄丰县公司将以零对价分别收购公司持有的昆明血塞通的10%、10%、10%、5%和4%的股权,并承担相对应的出资义务。截止本公告日,昆明昆药血塞通药物研究院有限公司股权转让协议尚未签署。本次股权转让不属于关联交易,也不属于重大资产重组。
华大基因:参与投资设立产业投资基金的进展
证券代码:300676 证券简称:华大基因 公告编号:2019-067
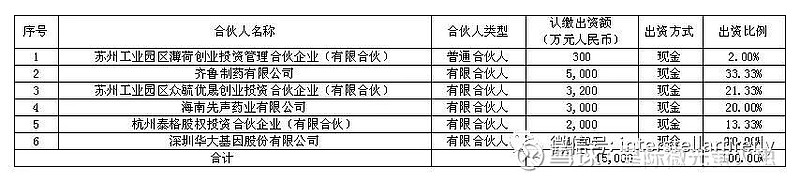
深圳华大基因股份有限公司于2019年4月23日召开第二届董事会第八次会议,审议通过了《关于拟参与投资设立产业投资基金的议案》,同意公司作为有限合伙人参与投资设立苏州工业园区薄荷天使二期创业投资企业(有限合伙)。该投资基金主要投资于生命科学和医疗健康领域,投资基金的目标规模为人民币3亿元,首期规模1.5亿元,公司拟以自有资金出资人民币1,500万元。具体内容详见公司于2019年4月25日发布在中国证监会指定的创业板信息披露网站巨潮资讯网(网页链接)的《第二届董事会第八次会议决议公告》(公告编号:2019-038)和《关于拟参与投资设立产业投资基金的公告》(2019-047)。
该投资基金的目标规模为人民币3亿元,首期1.5亿元募资规模已于近期认购完毕。苏州工业园区薄荷二期创业投资合伙企业(有限合伙)注册资本15,000万元人民币,其中,公司认缴出资额1,500万元,出资比例为10%。该投资基金各合伙人认缴出资额及出资比例如下:
一次性评价
复星医药: 控股子公司沈阳红旗药品异烟肼片通过仿制药一致性评价
证券代码:600196 股票简称:复星医药 编号:临2019-103
近日,上海复星医药(集团)股份有限公司控股子公司沈阳红旗制药有限公司收到国家药品监督管理局颁发的关于异烟肼片(规格:0.3g)的《药品补充申请批件》(批件号:2019B03243),该药品通过仿制药一致性评价。
药品名称:异烟肼片
剂型:片剂
规格:0.3g
注册分类:化学药品
药品生产企业:沈阳红旗
原批准文号:国药准字H21022351
审批结论:通过仿制药质量和疗效一致性评价
异烟肼片主要与其他抗结核药联合使用,适用于各型结核病的治疗。2019年3月,红旗制药异烟肼片(规格:0.1g)通过仿制药一致性评价。2018年度,沈阳红旗异烟肼片(规格:0.1g)于中国境内(不包括港澳台地区,下同)销售额约为人民币2,909万元(未经审计)、异烟肼片(规格:0.3g)未有销售额。
截至本公告日,于中国境内已上市的异烟肼片包括杭州民生药业有限公司的异烟肼片、成都锦华药业有限责任公司的异烟肼片等。根据IQVIA CHPA最新数据(由IQVIA提供,IQVIA是全球领先的医药健康产业专业信息和战略咨询服务提供商),2018年度,异烟肼片于中国境内销售额约为人民币9,436万元。
截至2019年6月,本集团(即本公司及控股子公司/单位)现阶段针对异烟肼片(包括0.1g及0.3g规格)一致性评价累计研发投入人民币约563万元(未经审核)
中国医药:子公司药品盐酸二甲双胍缓释片通过仿制药一致性评价
证券代码:600056 证券简称:中国医药 公告编号:临2019-015号
近日,中国医药健康产业股份有限公司下属全资子公司天方药业有限公司获得国家药品监督管理局核准签发的盐酸二甲双胍缓释片《药品补充申请批件》。有关情况如下:
一、批件基本信息
药品名称:盐酸二甲双胍缓释片
剂型:片剂
规格:0.5g
注册分类:化学药品
原药品批准文号:国药准字H20031225
审批结论:
根据《中华人民共和国药品管理法》、《国务院关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)及《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号)的规定,经审查,本品一致性评价通过。
二、药品相关情况
(一)盐酸二甲双胍片主要用于2型糖尿病的治疗。最初由默克雪兰诺公司开发,1995年在美国上市,然而由于普通制剂的患者服药依从性较差,2000年,百时美-施贵宝开发的缓释片在美国上市。
(二)国家药监局于2018年10月受理天方有限就该药品仿制药一致性评价提出的申请。
(三)截至本公告披露日,天方有限在该药品的一致性评价项目累计投入费用约为870万元人民币。
(四)据PDB数据显示,二甲双胍口服制剂2018年样本医院销售额约为6.33亿元人民币。目前该药品国内主要生产厂家有重庆康刻尔制药有限公司、正大天晴药业集团股份有限公司、上海上药信谊药厂有限公司、北京万辉双鹤药业有限责任公司等。

第2部分:报告分享



![]() :【关注微信公众号“星际微光”,后台免费领取报告】
:【关注微信公众号“星际微光”,后台免费领取报告】
今日报告:
埃森哲:人工智能应用之道(高管指南)(92p)
回复“5069”获得报告原文
往期报告:
china_health_reform_full
2019_麦肯锡_中国与世界:理解变化中的经济联系
牛津-机器人如何影响世界报告(中英双语)
2019中国医疗大数据研究报告
医疗行业香港联交所主板上市法律问题探讨 李竟弘
2018年中国金融高净值客户健康白皮书-爱康国宾
数字化驱动下的智慧家庭医生服务报告_2019
2019年中医药行业市场前景研究报告
2018年中美独角兽研究报告-前瞻产业研究院
WESP2019_BOOK-situation and prospect
百年跃变:浮现中的智能化组织
2019五一出行预测报告
Vantage_PharmaMedtech_2018_Review
......
回复“6566”获得往期报告原文


Copyright © 2016-2019 Interstellar Firefly Ltd. All rights reserved
星际微光(北京)咨询顾问有限公司 版权所有