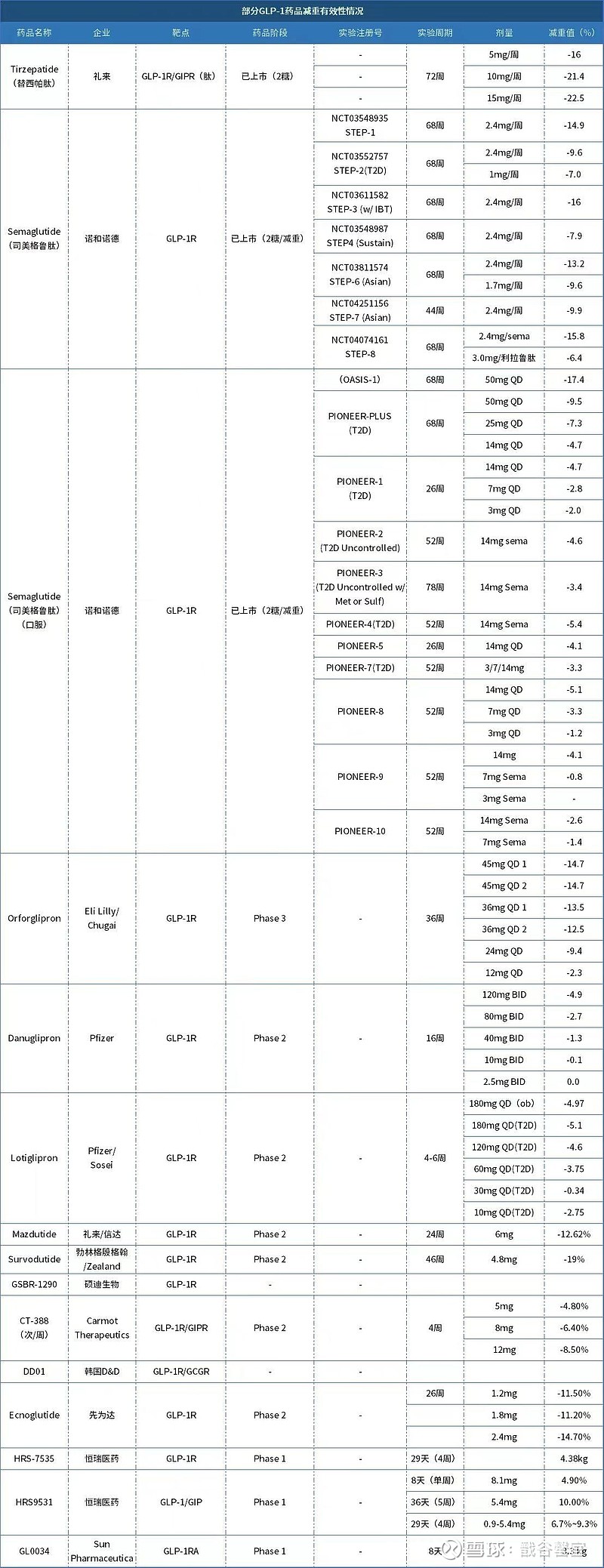
各公司GLP-1减重数据对比
 →更新:
→更新:
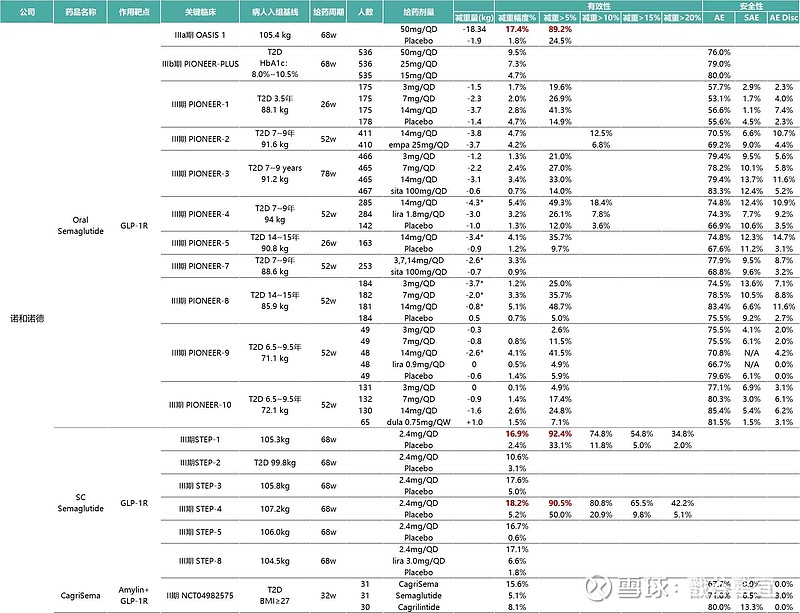
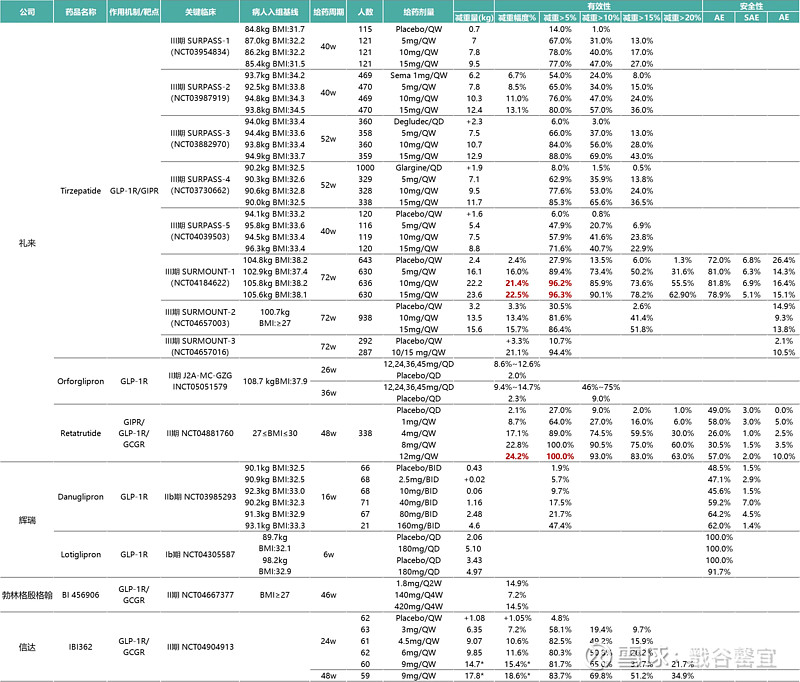
2024年5月16日,罗氏宣布其用于治疗肥胖和2型糖尿病的GLP-1/GIP双重激动剂CT-388的I期临床试验取得积极结果。研究发现,与安慰剂相比,健康肥胖成人试验参与者每周皮下注射一次CT-388,持续24周,可显著减轻体重,平均减重率为18.8%。在第24周,所有接受CT-388治疗的试验参与者体重减轻5%以上,85%的试验参与者体重减轻10%以上,70%体重减轻15%以上,45%体重减轻20%以上。
2024年6月14日,信达生物玛仕度肽治疗超重/肥胖三期临床GLORY-1的详细数据在美国糖尿病学会年会(ADA)上公布。主要终点为32周减重百分比,相比于安慰剂组,4mg剂量组减重10.72%,6mg剂量组减重13.14%。关键次要终点,治疗48周减重百分比,4mg剂量组减重11.58%,6mg剂量组减重14.37%。信达生物还公布了玛仕度肽9mg高剂量二期临床的最新数据,治疗24周减重15.4%。
→新增:
礼来LY3437943(GLP-1/GIP/GCG三重受体激动剂),试验338 名,分别接受1mg、4mg、8mg、12mg retatrutide或者安慰剂。第 24 周,1mg 组体重下降率为 7.2%,4mg 组 12.9%,8mg 组 17.3%,12mg 组 17.5%,安慰剂组为 1.6%。第 48 周,安慰剂组体重下降率 2.1%,1mg 组 8.7%,4mg 组 17.1%,8mg 和 12mg 组分别达到 22.8% 和 24.2%。
→2024 ADA会议数据整理
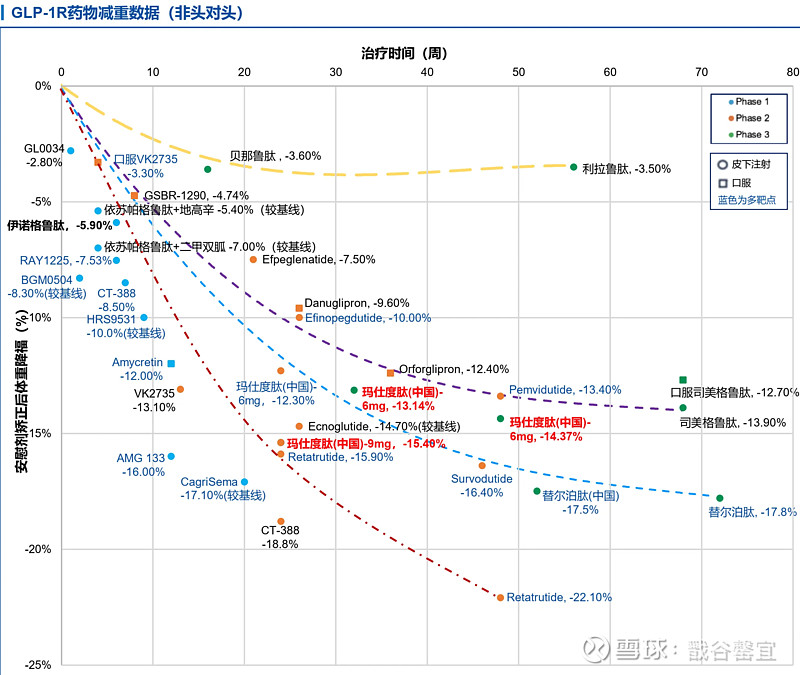
(1)【甘李药业】:GZR18(GLP-1单靶),35周,每周组减重-18.6%(计量未知,减重区间为11.6%-25.5%,最高剂量组减重25.5%),两周年组减重-13.5%(都安慰剂调整);基线BMI 32-36,体重91-100 kg;
(2)【恒瑞医药】:HRS9531(GLP-1/GIP双靶),24周,1 mg-6mg组减重区间-5.4%至-16.8%,6mg最高剂量组,减重-16.8%;
瑞医药公司在美国糖尿病协会科学年会(ADA2024)上以最新研究壁报(Late Breaking Poster)形式,首次披露其自主研发的GLP-1/GIP双受体激动剂HRS9531最新Ⅱ期研究结果。治疗24周后,HRS9531从低到高各个剂量组体重自基线分别下降5.4%、13.4%、14.0%、16.8%,而安慰剂组仅下降0.1%,各HRS9531组与安慰剂比较P均<0.0001。治疗24周后,HRS9531从低到高各个剂量组体重较基线减少≥5%的受试者比例分别为52.0%、88.2%、92.0%和91.8%,而安慰剂组仅10.2%。HRS9531耐受性良好,大多数不良事件(AE)为轻度或中度,未发现与治疗相关的严重不良事件(SAEs),无受试者因治疗相关不良事件(TRAEs)而停止治疗。该研究是一项随机、双盲、安慰剂对照的Ⅱ期研究(NCT05881837),纳入年龄在18~65岁、体重指数(BMI)为28~40 kg/m2的肥胖成年人,按照1:1:1:1:1的比例随机分配到HRS9531 1.0 mg、3.0 mg、4.5 mg和6.0 mg或安慰剂组,持续治疗24周。该研究共纳入249例受试者,其中240例(96.4%)完成了24周的双盲治疗期。各组的基线特征基本均衡。总体人群中,平均年龄34.2岁,48.2%为男性,平均体重91.5 kg,体重指数(BMI)32.2%。治疗24周后,HRS9531各组的体重较基线均显著降低,1.0 mg、3.0 mg、4.5 mg和6.0 mg组体重较基线变化百分比分别为-5.4%、-13.4%、-14.0%、-16.8%,而安慰剂组为-0.1%,各HRS9531组与安慰剂比较P均<0.0001。此外,HRS9531 各组随着治疗时间延长体重持续下降,基本呈剂量依赖性,6.0 mg组减重效果最为显著。在4个HRS9531组中,治疗24周时体重较基线减少≥5%的受试者比例分别为52.0%、88.2%、92.0%和91.8%,而安慰剂组仅10.2%。同样,HRS9531组体重较基线减少≥10%和≥15%的受试者比例均高于安慰剂组,其中以3.0 mg、4.5 mg和6.0 mg组更为突出。大多数不良事件(AE)为轻度或中度,最常见的AE为恶心、腹泻、食欲下降和呕吐,主要发生在剂量增加期间。未发现与治疗相关的SAEs,无受试者因TRAEs而停止治疗。该研究结果表明,HRS9531每周注射1次,治疗24周后显著降低肥胖受试者体重达16.8%,减重≥5%的受试者比例达92%,减重效果基本呈剂量依赖性。
(3)【信达生物】:玛仕度肽(GLP-1/GCG双靶),48周,6 mg组减重百分比-14.31%(安慰剂调整),基线BMI 31,体重 87 kg;24周,9 mg组减重-15.4%,基线BMI 34,体重97kg;
这是一项随机、双盲、安慰剂对照3期试验 (NCT05607680),旨在评估每周一次的GLP-1R和GCGR双激动剂在中国超重或肥胖参与者中的疗效和安全性。该项试验纳入600例受试者,按1:1:1的比例随机分配至玛仕度肽4mg组、玛仕度肽6mg组或安慰剂组,共治疗48周。主要终点是第32周时受试者体重相对基线的百分比变化以及体重相对基线下降≥5%的受试者比例。
相比于安慰剂组,4mg剂量组减重10.72%,6mg剂量组减重13.14%。关键次要终点,治疗48周减重百分比,4mg剂量组减重11.58%,6mg剂量组减重14.37%。同时,治疗48周心血管风险参数也都显著降低,相比于安慰剂组,玛仕度肽治疗组血压降低6.75mmHg,甘油三酯降低0.52mmol/L,总胆固醇降低0.45mmol/L,LDL-C降低0.31mmol/L,血尿酸降低50.75mmol/L,ALT降低10U/L。玛仕度肽达到了共同主要终点和所有关键的次要终点,在体重变化、减肥目标和多种心脏代谢危险因素的改善方面优于安慰剂。
信达生物还公布了玛仕度肽9mg高剂量二期临床的最新数据,治疗24周减重15.4%,肝脏脂肪减少73.3%。玛仕度肽9 mg
(4)【博瑞医药】:BGM0504(GLP-1/GIP双靶),2周,2.5/5mg-5/10mg-10/15mg减重百分比区间-3.24%至-8.30%,呈现剂量依赖性;
(5)【翰森制药】:HS-20094(GLP-1/GIP),4周,5-10-15mg vs 司美,HbA1c降低百分比-0.65% vs -0.75% vs -0.84% vs -0.59%;
HS-20094是翰森制药自主研发的胰高糖素样肽-1受体(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)受体双重激动剂,通过选择性激活GLP-1受体和GIP受体,促进胰岛素分泌,延缓胃排空,并抑制食欲减少进食量,进而产生控糖、减重及代谢改善等生物学效应,其给药方式为每周一次,皮下注射。研究结果显示共54例受试者接受了至少一次给药,其中HS-20094组、司美格鲁肽组和安慰剂组分别为36例、9例和9例。安全性方面在2型糖尿病受试者中,HS-20094的总体安全性和耐受性良好;最常见的胃肠道的AE,包括腹胀、恶心、腹泻等。AE严重程度主要为轻中度(98%),仅HS-20094 5mg组发生1例与研究药物无关的SAE;HS-20094 10mg组、HS-20094 15mg组、安慰剂组和司美格鲁肽组在研究的各个阶段均未发生SAE。药代动力学方面HS-20094连续4次皮下注射5-15mg后,平均Tmax为16h-24h,平均半衰期T1/2为142h-168h,暴露量(Cmax 和AUC)近似呈剂量比例化增加。在减重方面在4周研究周期中,HS-20094各剂量组的体重和体重指数均呈持续下降,下降幅度呈剂量依赖性,且下降幅度均显著优于安慰剂组。HS-20094 15mg组体重较基线下降幅度高于司美格鲁肽组。
(6)【先为达】:口服Ecnoglutide(GLP-1单靶),7-30mg/天,2周,减重百分比区间-3.63%至-6.55%,基线BMI 26;注射Ecnoglutide,0.6-1.2mg,24周,HbA1c降低-1.96%至-2.43%;
(7)【派格生物】:PB-718(GLP-1/GCG复方),12W,减重百分比区间-4至-6%;
(8)【质肽生物】:ZT002(GLP-1),这是一项1期、随机化、双盲、安慰剂对照、单次剂量递增试验。研究人员纳入了18~55岁健康成人受试者32例,其体重指数(BMI)为22~35 kg/m2。研究人员将患者随机分配至ZT002组(0.03 mg/kg、0.09 mg/kg、0.13 mg/kg、0.26 mg/kg)或安慰剂组。安全性方面,无受试者因严重不良事件、死亡或治疗后出现不良事件而退出研究,常见的与药物相关的不良事件为胃肠道反应,如恶心和呕吐,多为轻度或一过性反应。药物平均半衰期为260~273 小时,可每月或每2周注射一次。研究人员在4个ZT002剂量中均观察到第15天时受试者体重较基线有所降低,其中0.26 mg/kg的ZT002受试者体重较基线降低2.01 kg,相比于安慰剂组,该剂量所达到的具有临床意义的体重减轻效果可维持至第71天。