“免疫反应中的炎症因子会导致阿尔兹海默症的发生。”
2020 年 9 月 2 日,全球知名肿瘤研究机构特隆 · 凯瑟琳癌症研究中心(Memorial Sloan Kettering Cancer Center)李月明团队在 Nature 发表重要论文,他们给出的这一论断让医学界再一次意识到阿兹尔海默症 (AD) 这一疾病背后盘根错节的复杂作用。

图丨李月明团队发表的最新论文研究(来源:Nature)
生辉曾在第一时间报道了李月明团队的最新研究,但尚有一系列问题待进一步解答:这项 “首次直接阐明炎症反应与阿尔茨海默病关键蛋白的联系” 的工作是如何展开的?它的发现会对阿尔兹海默症的研究和治疗带来哪些新的方向?如今备受关注的几款药物的真实效果究竟如何?就此,在阿尔兹海默症研究领域有着近 23 年科研经历的李月明教授接受了生辉的专访。

(李月明,受访者提供)
揭开炎症诱导 AD 的面纱
从 1906 年德国病理学家 Alois Alzheimer 首次报告阿尔兹海默症这一疾病,迄今已经过去了 100 余年。期间,人类用多种理论丰富了对阿尔兹海默症这一疾病的解读。但略显沉重的是,我们仍未真正 “了解” 它。百余年的探索和研究带给我们的成果远不足以使人类摆脱阿尔茨海默病的困扰。
科学家探索出了几条 “了解” 这一疾病的路径。从最开始的 “胆碱能缺陷学说” 到以 “β淀粉样蛋白(Aβ) ” 为核心发病机制学说的创立,再到以 “载脂蛋白 E(ApoE) ” 为代表的研究路径,人类在混沌中探索。
李月明的研究始于 1997 年,在获得加州大学伯克利分校比较生物化学博士学位后,他又在哈佛大学医学院做完博士后,随后到默克研究室工作。那时,弄清楚 “γ- 分泌酶” 在阿尔兹海默症中扮演的角色,并研发相关药物是他重点从事的方向。
“在哈佛大学医学院工作的时候,我专注于抗菌素的研发,论文发在 Science。后来退行性神经疾病的治疗引发了我的关注,默克正好有这个项目。当时业内仅了解有γ- 分泌酶的存在,但还不清楚具体哪个蛋白参与它的作用过程,我们就展开了相关研究。”李月明如此谈及过去的经历。
如其所述。与目前大量研究 Tau, Trem2 和 ApoE4 的工作不同,李月明更为关注γ- 分泌酶。早期的研究发现,在早发性阿尔兹海默症,即在 65 岁之前发病的患者中,患者体内存在 γ- 分泌酶相关基因,且几乎 100% 会将疾病遗传给下一代。但是迟发性的阿尔兹海默症,即在 65 岁之后发病的患者体内,γ- 分泌酶在其中起到什么作用大家还不是很清楚。
“早发性、迟发性阿尔兹海默症患者的病理特征是完全一样的。但对于迟发性阿尔兹海默症中 γ- 分泌酶的作用,研究十分困难,相关的系统研究很少。因此我们就想要去探究这背后隐藏的关系。”李月明说。
γ- 分泌酶是何方神圣?阿尔兹海默症的标志性症状之一是患者大脑中有β- 淀粉样蛋白沉淀(Aβ),而β- 淀粉样蛋白的产生由β- 淀粉样前体蛋白 (APP) 切割产生的小肽聚集而成。在此切割过程中,最为关键的蛋白酶便是 γ- 分泌酶。也就是说,γ- 分泌酶诱导了β- 淀粉样蛋白沉淀的生成。
γ- 分泌酶是如何诱导这一过程的?又有哪些因子在其中扮演着调控的作用?
李月明的研究从这一问题开始。其团队在之前的研究中发现,低氧的条件下γ- 分泌酶活性会显著提升。随着研究的深入,李月明发现,炎症因子 “干扰素诱导的跨膜蛋白 3(IFITM3)” 是 γ- 分泌酶的重要调控蛋白。IFITM3 的表达又与另一个过程产生了联系——人体免疫反应。
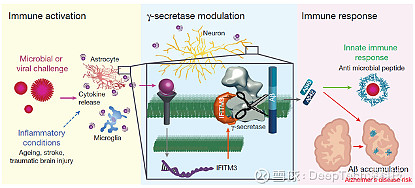
图丨 IFITM3 蛋白是连接感染、先天免疫与 Aβ产生及 AD 风险的桥梁(来源:上述论文)
“我们发现,免疫反应中的重要参与对象炎性细胞因子可让 FITM3 在神经元和星形胶质细胞中表达,FITM3 又能上调 γ- 分泌酶的活性,从而增加淀粉样蛋白 -β的产生。”李月明解释到,“这是一个完整的调控路径,最上游是免疫反应中的炎症因子,最下游是淀粉样蛋白 -β的生成。”阿尔兹海默症与人体免疫过程中的联系就此被发现。
这一发现会对阿尔兹海默症的治疗注入哪些新鲜血液?
热门疗法和药物的“是非题”
很早科学家们就已经意识到,阿尔兹海默症不是简单的单一诱因疾病。族群、环境和遗传因素等多重影响让阿尔兹海默症治疗需要匹配不同的个性化方案。李月明认为,想要用一种药物去治疗所有类型的阿尔兹海默症患者十分困难。
“导致阿尔兹海默症发生的原因不仅仅只是一个‘影子’( β- 淀粉样蛋白沉淀的体外检测特征)那么简单,不同病人的脑内都存在β- 淀粉斑点,这是一个共性,但共性因素背后的成因完全不同,这也是目前大家所做的相关药物很多都没有成功的原因。”李月明对生辉解释,“目前的药物,仅仅是针对某种验证因子去调控治疗疾病。遗传学的最新研究却发现,基因与早发性阿尔兹海默症的发生有很大关系,主要和 3 个基因有关:PS1、PS2、β⁃淀粉样蛋白前体 (APP) 基因,如果人体内含有上述病理突变基因,那么疾病会 100% 遗传给后代。但 95% 以上的阿尔兹海默症是迟发性的,大家最早找到的相关基因是 ApoE4,是危险因子,不是致病因子。”
针对目前的热门药物——渤健(Biogen)和卫材(Eisai)联合开发的阿尔茨海默病阿杜那单抗(Aducanumab),临床试验一波三折。阿杜那单抗曾在 2019 年 3 月被宣布无效并终止了临床试验,但又于 12 月底“起死回生”,重生的原因是研究人员对患者数据进行重新分析后发现,在使用剂量 10 毫克 / 千克体重的小组中,患者的认知能力得到了显著改善,主要体现在临床痴呆评定量表(CDR - SB)和简易精神状态检查(MMSE)的评估当中。但业内对这款药的真实疗效一直众说纷纭。
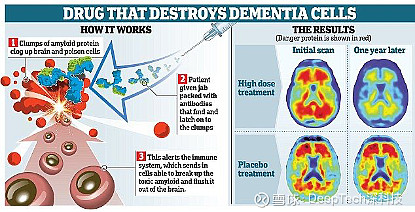
图丨 Aducanumab 治疗过程示意图(来源:Biogen)
李月明认为,目前,领域内不同的人对此抱有不同的观点。“从我们在专业会议上讨论的结果来看,大家对渤健药物是否有效的看法是有争议的。渤健是将所有数据整合后又进行了二次考量,在过去的实验中,这款药物最早并没有把 ApoE 4 的病人算在其中,现在,如果将 ApoE 4 的病人数据纳入组内,再加大剂量展开试验可能会产生一定的效果。”
目前针对这款药物业内有两种声音。第一种观点认为,目前针对阿尔兹海默症并没有什么药物,如果有一定的疗效应该予以批准;另一种观点认为,渤健需要更多的数据来支持他药物的疗效。“我们现在都在看 FDA 如何决断,是批准了还是需要更多的数据,但有一点无法回避的是,目前阿尔兹海默症的临床试验非常昂贵,这是也是扩大试验比较困难的因素之一。”
而针对目前热点的新疗法,如干细胞疗法,李月明认为想要通过这种方式治疗阿尔兹海默症,目前还有很多难题需要解决。“这是很好的一个思路,但是在试验中对小鼠进行病理特征检测、给药等过程的可控性比在人体内进行试验高很多,真正作用到人脑内,干细胞能否实现神经元的准确连接,这一问题还需要时间的验证。”
探索癌症和阿尔兹海默症之间的联系
谈及未来的计划,李月明表示未来的研究将重点围绕在三个方向,第一、深入挖掘阿尔兹海默症的机理。炎症因子除了对γ- 分泌酶起到调控作用外,还对其它哪些物质产生调控作用;第二,通过研究病人的样本,观察病人体内血液和脑内的 IFITM3 含量和正常人之间是否存在差异,探究 IFITM3 成为另一种可检测的阿尔兹海默症生物标记物的可能性;第三,开发一些小分子和大分子药物,对阿尔兹海默症进行治疗。
此外,李月明还告诉生辉一个有趣的发现,也是未来的研究目标之一——探究癌症和阿尔兹海默症之间的联系。
李月明表示,根据已发表的统计数据,患者一旦患有阿尔兹海默症,那么该患者再患癌症的概率就会大幅降低;患者一旦患有癌症,那么该患者再患阿尔兹海默症的概率也会降低,二者之间存在负相关性。“这个数据发现十分有趣,阿尔兹海默症是神经细胞的凋亡导致的,而癌症却是癌细胞的迅速增殖产生的。因此未来我们希望能够研究探讨二者之间存在哪些联系。在机理层面有一定的了解之后,就可以寻找一个小分子,让他既能控制癌细胞的生长,又能调控阿尔兹海默症导致的神经细胞的凋亡。”
谈及中国学者对阿尔兹海默症的研究和贡献,李月明也对施一公等人的研究表达了肯定。李月明认为,施一公对γ- 分泌酶的研究给后续的许多研究奠定了坚实的基础。“大家希望通过自己的研究去攻克阿尔兹海默症这一疾病。我的一位朋友曾经说过,即使我所做的基础研究并没有实现药物的开发,但它如果可以帮助别人把治疗的药物做出来,就足够了。”
关于李月明
李月明博士现为斯隆 - 凯特琳癌症中心的终身教授, 康奈尔大学威尔医学院药理学和神经科学教授。在获得加州大学伯克利分校的博士学位和哈佛医学院的博士后、2002 年进入斯隆-凯特琳癌症中心之前,李月明在默克研究室工作了 5 年,在那里从事药物研发。李月明曾获得阿尔茨海默氏症协会的 Zenith Fellow 奖和 MetLife Foundation Awards 医学研究奖,以表彰他在阿尔茨海默氏症方面所做出的杰出贡献,并于 2016 年当选为美国科学促进协会会员。
关于李月明实验室
李月明实验室重点研究与衰老相关的人类疾病,例如阿尔茨海默氏病(AD)和癌症,研究方向还包括γ- 分泌酶的功能调节、自噬、神经炎症和先天免疫,研究范围包括从疾病机理到治疗发展。
-End-


