来源:博药公众号
作者:森林

图片来源:摄图网
2024年上半年,美国食品药品监督管理局(FDA)批准了21款1类新药,中国国家药品监督管理局(NMPA)批准了26款1类新药。
本文将分别盘点中美获批的这些新药,并比较两国获批新药在药物类型、适应症等方面的异同。
21款新药
FDA批准上市
截至2024年6月底,美国食品药品监督管理局(FDA)药品评价研究中心(CDER)共批准了21种新药,包括17个化药和6个生物药,批准数量比2023年同期略低,但仍处于历史平均水平以上。
图1. 美国FDA历年批准的新药数量
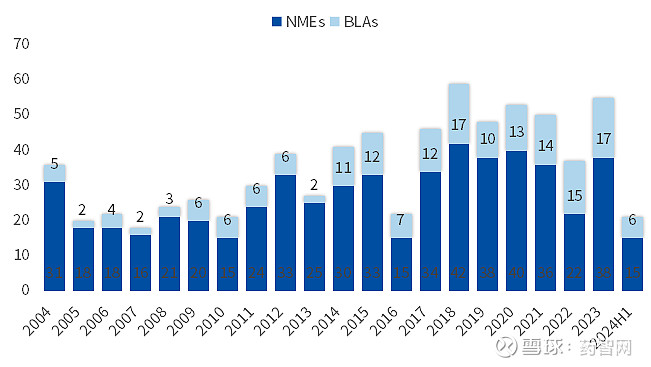
数据来源:FDA官网、博药整理
表1. 2024H1美国FDA CDER批准的新药
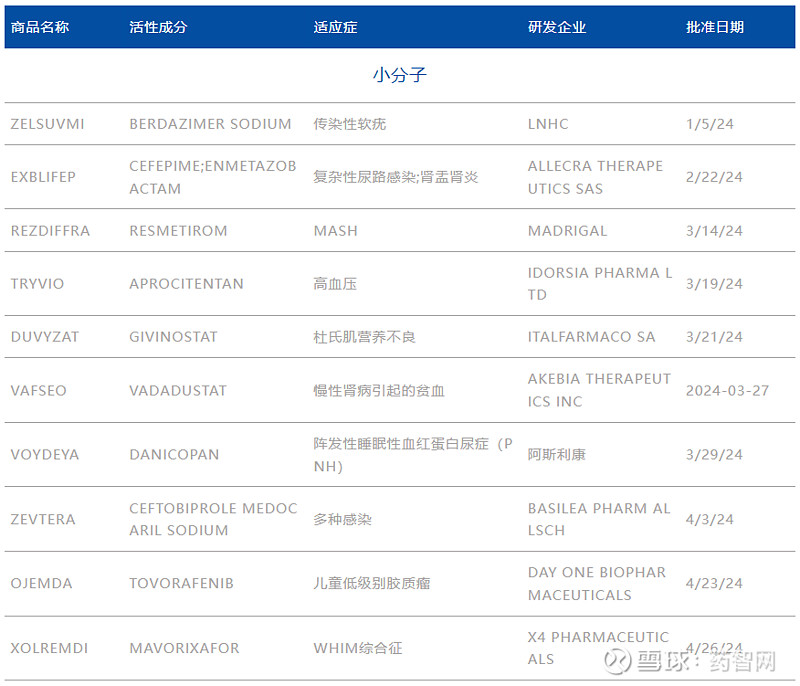
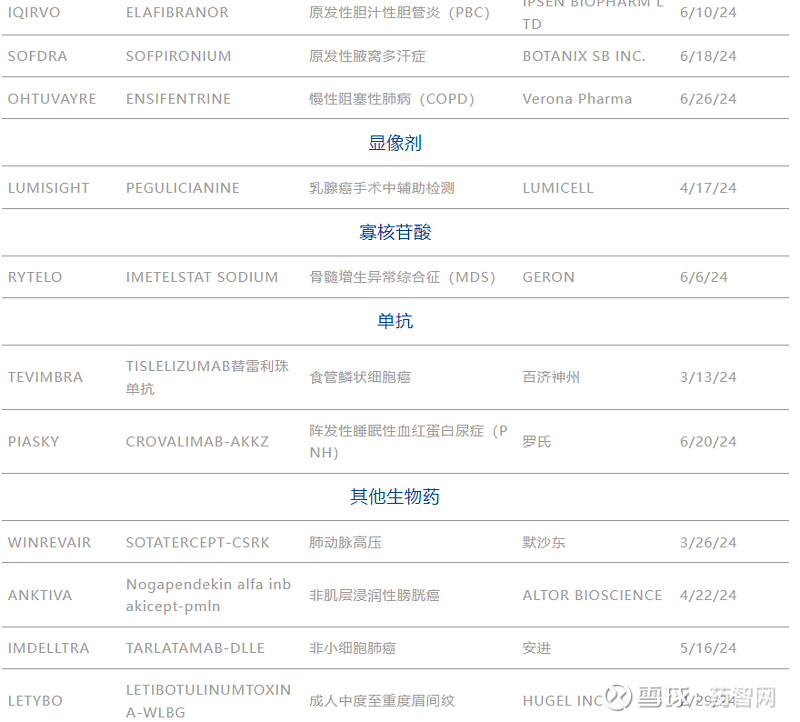
注:清单包括CDER批准的多种新药及部分生物制品,不包括疫苗、过敏性产品、血液和血液制品、血浆衍生物、细胞和基因治疗产品,以及生物制品评估和研究中心在2024年批准的其他产品。
数据来源:FDA官网、博药整理
26款新药
NMPA批准上市
截至2024年6月底,中国国家药品监督管理局(NMPA)药品评价研究中心(CDE)共批准了26种新药,包括15个化药、8个生物药和3个中药,批准数量比2023年同期(24个)有一定增长。
表2. 2024H1 NMPA获批上市的1类新药
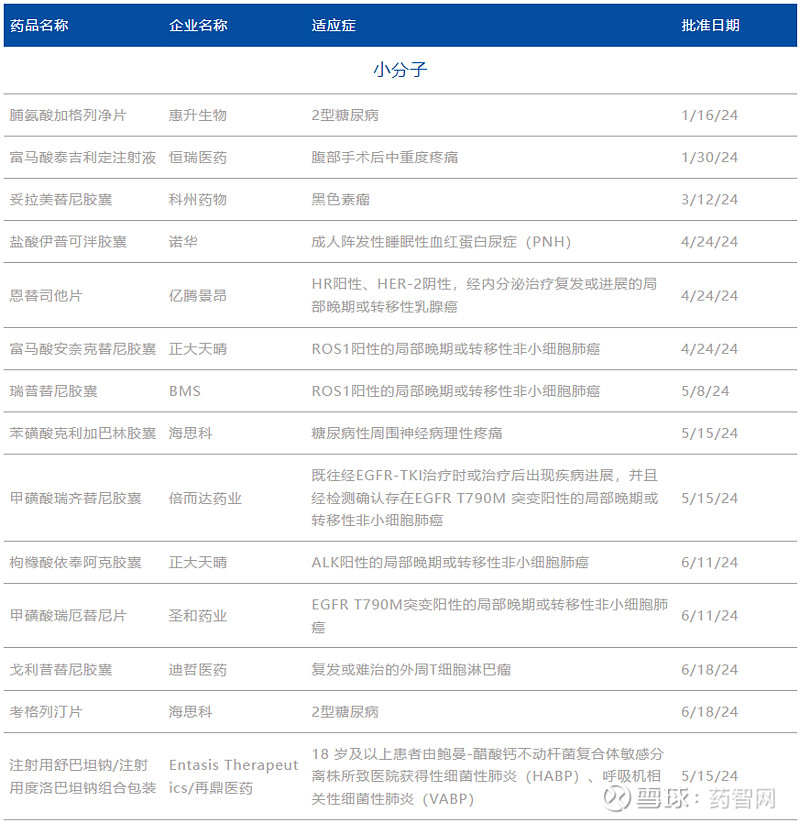
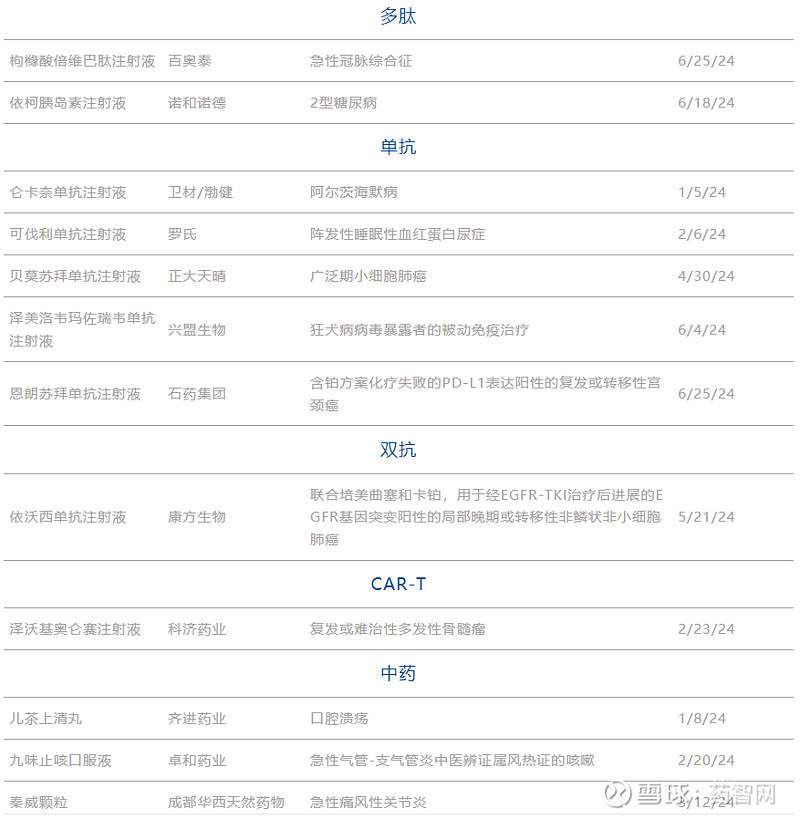
数据来源:药智数据、药智头条整理
中美异同
适应症、药物类型对比分析
从批准数量来看,今年上半年NMPA批准的新药有26个,比美国CDER批准的新药(21个)多近20%。如果剔除中国特色的中药和不属于CDER批准范畴的细胞疗法,则NMPA批准的新药数为22个,比美国CDER批准的新药多1个。
从药物类型来看,无论是中国还是美国,小分子都是获批新药的主要类型,占比均超过一半。其次为发展较为成熟的抗体药物。另外,新型药物如双特异性T细胞接合器、双抗、CAR-T疗法中美各有涉猎,但数量不多。
图2. 2024上半年美国CDER批准新药药物类型分布
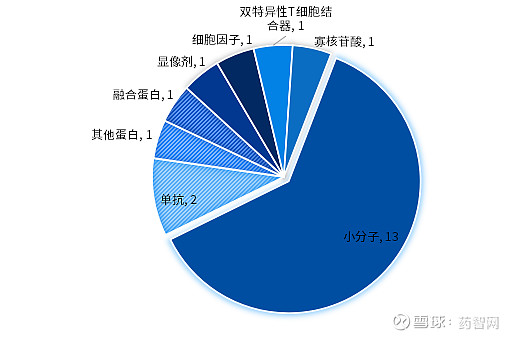
数据来源:FDA官网、博药整理
图3. 2024上半年NMPA批准新药药物类型分布
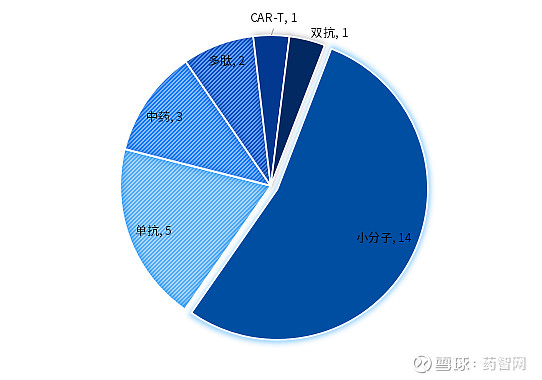
数据来源:药智数据、博药整理
从某种程度上而言,在研药物领域的创新技术与获批上市的药品技术存在一定时间差,目前较热门ADC、CAR-T等领域在新药获批层面上还未体现,而从目前新药研发领域由小分子药向生物药转变的趋势上来看,后续生物药新药获批数量或许会越来越高。
从适应症来看,中美获批的新药中都是抗肿瘤新药最多,但是中国占比更高,接近50%,而美国为29%。从具体癌种来看,中国获批的12个肿瘤新药中有7个用于肺癌(6个非小细胞肺癌、1个小细胞肺癌)治疗,血液瘤2个,宫颈癌、乳腺癌、黑色素瘤各1个。而在美国获批的肿瘤新药中癌种较分散,包括食管癌、乳腺癌、胶质瘤等。
这一系列中美差异点,或许正是国内新药同质化的原因之一,拥抱热门不可厚非,但强调差异化发展,如艾伯维一般进行建立核心疾病领域优势,对于国内创新药企业或许更值得学习。
其次,抗感染、血液疾病、代谢性疾病、心血管疾病用药也是新药研发的热门领域。
另外,罕见病作为美国新药开发和获批的重点领域,2024上半年获批的新药中有10个新药曾获得孤儿药认证,包括4个罕见肿瘤用药,2个血液罕见病用药,以及4个其他罕见病用药。而在中国,2024上半年获批上市的1类新药中,仅有2个进口1类罕见病新药获批用于治疗成人阵发性睡眠性血红蛋白尿症(PNH)患者,尚未出现国产自主研发的罕见病新药。当然,还有部分罕见病新药以5.1类新药申报并获批进口,不在本文统计范围内。
这一点上,或许某种程度上也意味着中国新药“源头创新”意愿的不足,对于罕见病等临床上需求迫切的领域,反而因为市场空间、技术难度等问题而推进缓慢,这一点上或许有待加强。
图4. 2024上半年美国CDER批准新药疾病领域分布
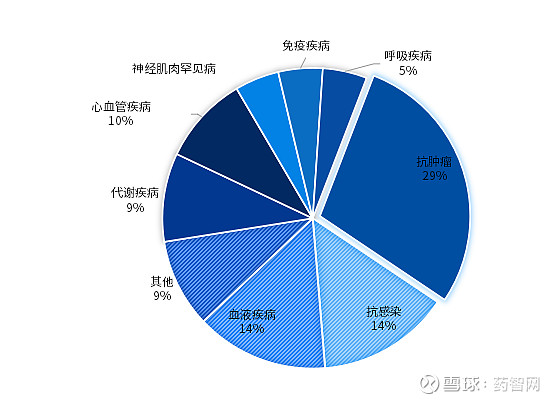
数据来源:FDA官网、博药整理
图5. 2024上半年NMPA批准新药疾病领域分布
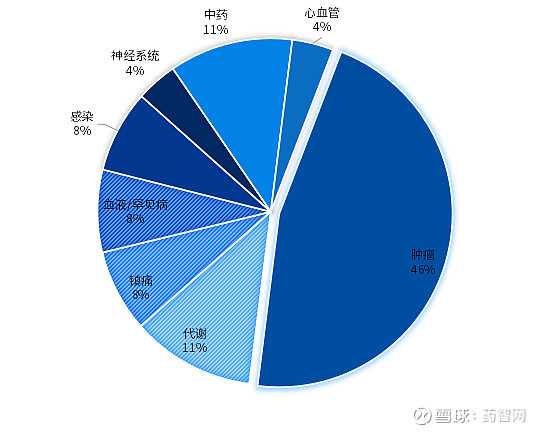
数据来源:药智数据、博药整理
从企业来看,罗氏(Roche)开发的新一代C5循环抗体Piasky(crovalimab,可伐利单抗)同时在中美获批上市,用以治疗阵发性睡眠性血红蛋白尿症(PNH)患者。
美国FDA批准的新药少部分来自跨国大药企,如默沙东、阿斯利康、安进等,多数来自美国的生物技术公司,例如MADRIGAL、AKEBIA、ALTOR BIOSCIENCE等。
NMPA批准的新药同样少部分来自跨国大药企,如BMS、诺华等,多数来自中国的药企和生物技术公司,例如恒瑞医药、石药集团、正大天晴、倍而达药业、科济药业、康方生物等。
从审评方式来看,2024上半年美国有10个新药通过快速审批方式获得批准,占所有获批新药的48%;中国有9个新药通过优先审批获得批准,占所有获批新药的35%,可见快速审批、优先审批已是新药获得批准的重要途径。
小结
近年来,在特别审批、突破性治疗药物、附条件批准、优先审评审批等药品加快上市注册程序下,NMPA批准新药数量快速增长。2022年NMPA批准了23个1类新药,2023年这一数字增长到40个,而今年上半年就已批准了26个1类新药,超过美国FDA批准的1类新药数量,今年全年批准新药数量有望再创新高。
但是,在适应症方面,国内新药主要集中在抗肿瘤领域,尤其是肺癌领域。而FDA批准的新药适应症罕见病和罕见肿瘤占据很大比例。这与国内外市场环境差异、创新药发展历程长短有关。目前而言,国外市场更鼓励去探索一些更新的靶点和适应症,对于比较新的靶点,药企也偏向于出海去寻找机会。
未来,相信随着政策的支持、支付环境的改善,国内也有望迎来更多创新疗法。
资料来源:
美国FDA官网
NMPA官网
药智数据
各企业公开资料
博腾股份为全球药企、生物科技公司、科研机构等提供从临床前研究到药品上市全生命周期所需的小分子药物、多肽与寡核苷酸、生物大分子(mAb, ADC等)以及基因与细胞治疗药物等一站式服务解决方案,研发、生产、运营场地覆盖中国(重庆、上海、四川、江苏、江西、湖北)、美国、斯洛文尼亚、比利时、瑞士和丹麦等地。我们致力于以客户为中心,为客户提供卓越的全球化、端到端CDMO服务,让好药更早惠及大众。
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表药智网立场。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。