来源:博药公众号
作者:metallic
自1998年RNA干扰(RNAi)现象的发现以来,25年里这一技术已从发现走向了临床应用,为遗传性疾病治疗提供了新的可能性。
突破
RNAi药物从发现到临床应用
1998年,RNA干扰(RNA interference,RNAi)现象首次被发现。这是一种转录后水平的基因表达调控技术,能够使与之同源的靶基因mRNA特异性降解或翻译受阻,从而达到基因沉默的效果。RNAi技术的发现为基因表达调控提供了新的机制,特别是在治疗遗传性疾病方面,被授予了2006年诺贝尔生理学或医学奖。
小干扰RNA(small interference RNA, siRNA)药物正是基于RNAi技术的一种新型治疗方法,具有特异性沉默几乎任何治疗靶点的潜力,拥有前所未有的效力和持久性。
2018年,FDA批准了首款siRNA药物——Onpattro(Patisiran),由Alnylam公司开发用于治疗hATTR患者,代表了一种治疗疾病的全新方法。该药基于脂质纳米颗粒(LNPs)递送,这也是目前市场上唯一利用这一技术平台的siRNA药物。
此后,肝脏递送的主要平台由更有效的GalNAc偶联技术取代。目前,全球已有6个siRNA药物获批上市。
表1. 全球已上市的6个siRNA药物
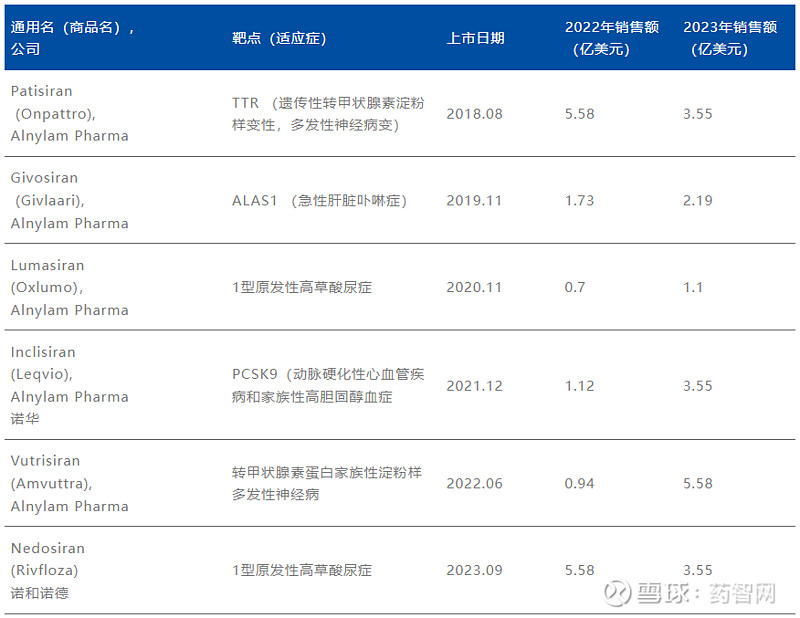
资料来源:FDA官网、博药整理
图1:Patisiran (Onpattro)结构式(2018年)
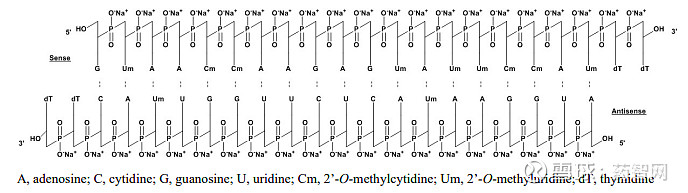
图片来源: 药融圈
图2:Rivfloza结构式(2023年)
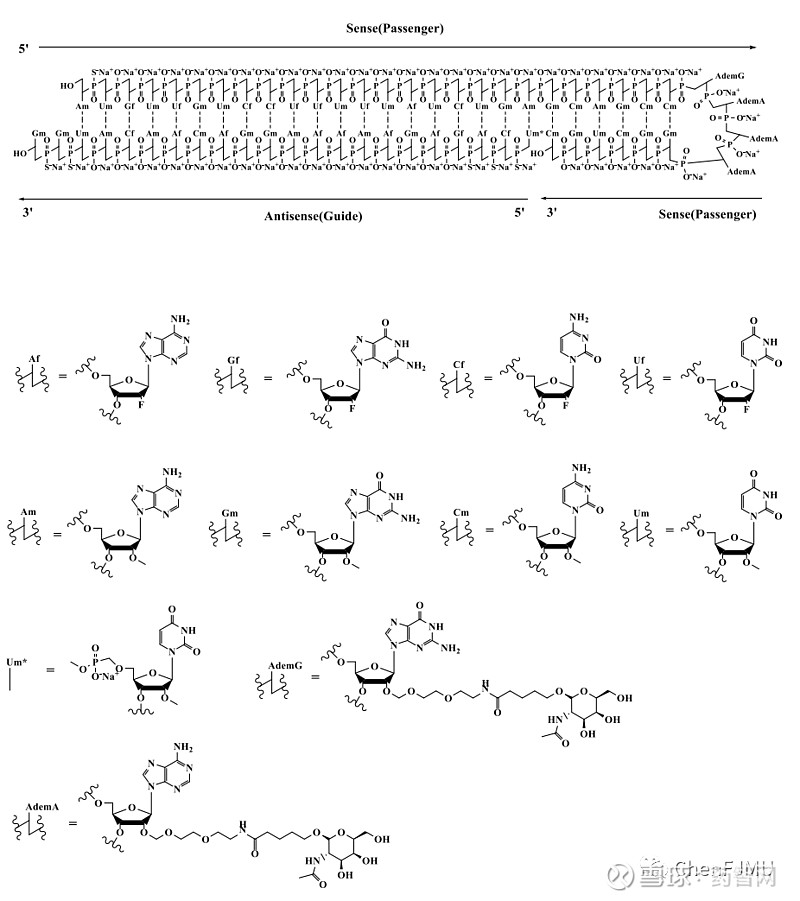
图片来源:ChenFJMU
然而,siRNA药物仍面临诸多挑战,尤其是递送问题。目前已获批上市的siRNA药物全部都靶向肝内组织,治疗肝外疾病的效用仍然有限,还需要持续的创新。
挑战与创新
影响siRNA药物疗效的因素
尽管siRNA药物展现出巨大潜力,但其在体内的稳定性和生物利用度仍是主要挑战。化学修饰、计算机辅助设计和生物筛选、优化递送策略等方面的创新,为siRNA药物研发带来了新的希望和突破点。
化学修饰
由于siRNA药物是基于RNA结构进行设计的,而人体内又存在很多水解RNA的酶,因此在人的循环系统中,siRNA药物非常容易被水解掉,其表现为稳定性不足;另外一方面,siRNA药物是带有负电荷的核酸大分子,原则上很难通过细胞膜进入细胞内部发生作用;并且,siRNA还可以触发先天免疫反应并引起脱靶效应。
对 siRNA 进行化学修饰,可以提高其在血液中的化学稳定性、增加半衰期、降低免疫效应和脱靶效应。还可以在药物上连接一些配体,当配体与特定组织上的受体结合时,会引起特定细胞的内吞作用,使得 RNAi 药物具有靶向运输能力。
磷酸修饰:裸siRNA的核苷酸之间通过3',5'-磷酸二酯键连接,带有负电荷,容易被血液中的磷酸酶降解。最常见的修饰是将易被水解的磷酸二酯(phosphodiester,PO)替换为硫代磷酸酯(phosphorothioate,PS),可以显著地稳定 RNA 对核酸酶的降解,但过多的 PS 修饰可能导致毒性增加。除此之外,还可以将硼酸磷酸酯(BP)取代 ,效力更高,但目前缺乏大规模合成的优化方法。
核糖修饰:最常见的核糖修饰位点为核苷酸的 2'位,包括 2'-O-Me 和 2'-F,可以提高核酸酶抗性和结合亲和力,延长半衰期,使 siRNA 稳定性增强。此外,还可以引入锁核酸(LNA)修饰,即核糖的 2'-O 与 4'-C 之间形成共价键。将 LNA 插入 siRNA 序列可以增加生物稳定性和靶标结合亲和力。
碱基修饰:siRNA与mRNA 通过碱基互补形成氢键发挥作用,因此对碱基进行修饰会对 siRNA 的性能产生影响。常见的碱基修饰方法是用 5'-溴尿嘧啶、假尿嘧啶、2'-硫尿嘧啶、5'-碘尿嘧啶取代碱基,可以促进核苷酸之间氢键的形成,一定程度上提高稳定性。
综合考虑不同方面的化学结构调整,可以优化siRNA的靶向性和安全性,为其在治疗应用中的应用提供更广阔的前景。
图3. siRNA结构修饰策略
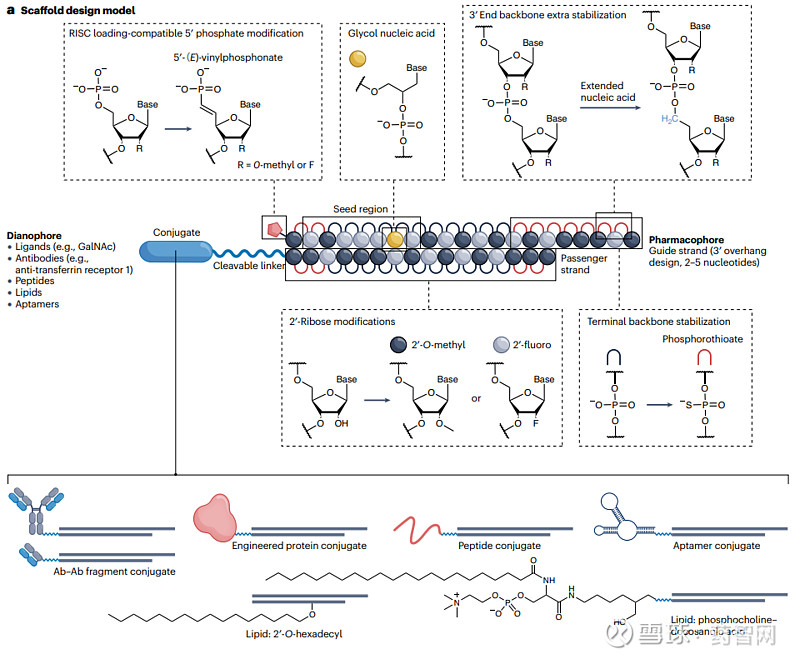
图片来源:参考资料1
计算机辅助设计和生物筛选
siRNA的设计和生物筛选对疗效和安全性至关重要。通过计算机辅助设计,研究人员可以利用算法预测siRNA序列的功效和特异性。这些算法综合考虑了目标mRNA的可及性、热力学稳定性和非靶效应等因素。随后,潜在的siRNA候选序列还需要通过生物筛选来验证其活性和选择性。
siRNA的修饰策略对其体内功能性具有显著影响。但目前大多数公开可用的siRNA预测算法是基于未修饰的siRNA数据集,这限制了它们对修饰siRNA的预测能力。
在体外识别siRNA的活性较为简单,但体外效力并不总是能够直接转化为体内活性。因此,需要综合考虑体外和体内效力,并持续创新以提高预测准确性。
靶点特异性是设计siRNA时需要考虑的另一个关键因素。由于脱靶而产生的毒性在体内与体外仍然存在差异,这也是需要考虑的因素。
跨物种的siRNA设计可以简化临床前开发过程,但需要对人类和其他物种的靶序列同源性进行分析。在跨物种活性差异方面,仍然缺乏深入的生物学机制解释,需要更多的研究和创新。
递送策略
递送siRNA至目标细胞是RNAi疗法中不可忽视的一关。
为了克服siRNA递送的挑战,科学家们开发了各种递送方法,主要可分为病毒载体和非病毒载体;前者通常使用逆转录病毒、腺病毒等作为递送载体,具有较高的递送效率,但免疫反应风险和毒性等问题,限制了其临床应用。
相比之下,非病毒载体以其低毒性而具有更大的开发潜力,比如基于脂质体的纳米递送系统 和偶联介导的递送系统。
目前,LNP(脂质纳米颗粒)平台与GalNAc共轭连接递送系统平台已有产品获批上市。另外,Dicerna公司(已被诺和诺德收购)肝脏靶向的GalXC™递送平台可实现RNAi疗法的皮下给药,基于该平台开发的Nedosiran (Rivfloza)已于2023年获批上市,用于原发性高草酸尿症(PH)。
在肝外递送方面,Alnylam公司开发了十六烷基C16偶联技术,以鞘内给药方式尝试向中枢神经系统和眼部的递送,以及IKARIA™平台,对肺部、肌肉和脂肪组织的siRNA递送方法进行了改进。Codiak公司开发了外泌体递送平台。
此外,近年来无载体递送系统成为一种具有潜力的递送策略,将纳米药物递送与自组装技术相结合,在不借助载体材料的情况下,siRNA 之间自组装或与其他药物共组装,形成均匀稳定的纳米粒,这些纳米粒具有自递送能力,即同时作为递送载体和被递送的对象,包括脂质 siRNA 偶联物、抗体-siRNA 偶联物、多肽 siRNA 偶联物、核酸适配体-siRNA 结合物以及siRNA 与其他药物的共组装。
随着新材料、新技术和新策略的不断发展,siRNA的递送将会更加高效和安全,以实现siRNA药物的广泛应用。
未来
siRNA药物前景辽阔
siRNA药物具有明显的优势,包括“不可成药”的靶点、相对较短的开发周期以及长期稳定的临床疗效,这些优势使其已成为药物研发领域的一大亮点。展望未来,siRNA药物的应用范围预计将实现大幅扩展。
目前,多项使用脂质和抗体-蛋白质共轭物递送siRNA的临床项目已展现出显著的疾病治疗效果,这一进步可能预示着下一轮siRNA药物批准的浪潮即将到来。
图4. 临床适应症和靶标选择
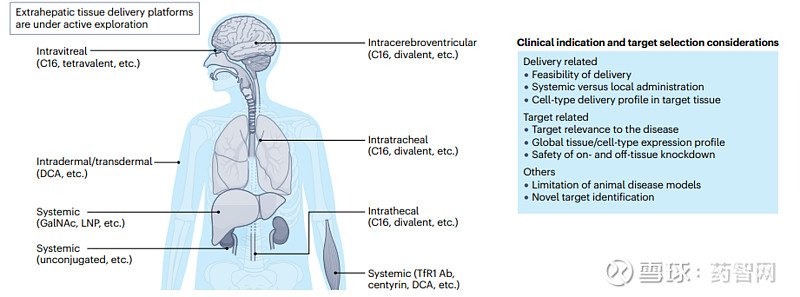
图片来源:参考资料1
在治疗肝病领域,siRNA药物已被视为一种首选的治疗策略,并已经获得临床验证。siRNA药物因其较低的用药频率和便利性,有望取代某些传统药物siRNA药物的持久性和安全性可能基因编辑方法获得临床接受的先决条件。例如,针对乙型肝炎的siRNA药物已进入了临床验证阶段。
此外,siRNA还可以作为长非编码RNA的治疗靶点,为治疗特定疾病提供新的选择。尽管目前对于针对长非编码RNA的药物研发仍处于初级阶段,但siRNA和其他寡核苷酸为基础的治疗方法在这一领域展现出了极高的潜力,未来有望在这一领域取得突破。
最后,siRNA与其他药物模式结合可能产生协同效应,为治疗复杂疾病带来新的可能性。例如,Alnylam的靶向C5补体siRNA药物cemdisiran与Regeneron的C5补体抑制剂pozelimab联合疗法在治疗阵发性夜间血红蛋白尿(PNH)显示出潜力。
未来,siRNA药物在临床应用中的潜力将继续被挖掘和拓展,我们有望看到更多具有广泛应用前景的RNAi药物问世。
参考资料
刘珂瑶,罗应楠,胡一雪,王东纳,张列峰.siRNA 无载体递送研究进展[J/OL].南京师大学报自然科学版.
黄新新. RNAi药物研究进展 [J]. 中国处方药, 2021, 19 (09): 19-20.
博腾股份为全球药企、生物科技公司、科研机构等提供从临床前研究到药品上市全生命周期所需的小分子药物、多肽与寡核苷酸、生物大分子(mAb, ADC等)以及基因与细胞治疗药物等一站式服务解决方案,研发、生产、运营场地覆盖中国(重庆、上海、四川、江苏、江西、湖北)、美国、斯洛文尼亚、比利时、瑞士和丹麦等地。我们致力于以客户为中心,为客户提供卓越的全球化、端到端CDMO服务,让好药更早惠及大众。
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表药智网立场。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。