填补空白!ICH发布分析方法开发及验证指南
来源:博药/红辣椒
行业内相关的GxP流程之一是分析方法验证流程,它与常规使用的分析方法(释放、稳定性)直接相关。但一直以来,ICH并没有关于分析方法开发的指南。
2018年,ICH决定制定关于分析方法开发的质量指南即Q14AnalyticalProcedureDevelopment,并修订关于分析方法验证的ICHQ2(R1)指南即Q2(R2)ValidationofAnalyticalProcedures。Q2(R2)和Q14旨在补充Q8到Q12指南,以及正在制定中的ICHQ13ContinuousManufacturing《连续制造指南》。
经过三年的准备,ICHQ14和ICHQ2(R2)的两份文件已于今年的3月24日公布,目前处于Step3阶段,按照计划其将在2023年5月前完成Step4的定稿。
Q14分析方法开发指南
由于目前没有关于分析方法开发的ICH指南,申请者往往只报告分析验证结果,很少提出性能评价和分析开发结果。这使得监管沟通无效,特别是当采用非常规的分析程序时(例如,用于过程控制的RTRT和多变量模型)。此外,由于缺乏指导原则,申请人没有机会对批准后的分析程序变化提出灵活的监管方法(如质量设计(QbD)概念)的科学依据。
据ICH称,新指南的提出是为了协调分析方法开发的科学方法,并提供与分析方法开发过程描述有关的原则。根据目前发布的草案来看,Q14确实达到了它的制定预期,虽不到极致精致实用,但作为填补空白的第一遭很是合格。
首先它是一个广泛的指南,涵盖了基于ICHQ8(药物开发)和ICHQ9(质量风险管理原则)的分析程序开发。它规定了分析方法开发的基础方式和增强方式的要素,尽管基础方法仍能被接受,但增强方式的部分或全部元素得到增强,能更好地理解分析程序参数的影响,以及更大的生命周期管理灵活性,例如更广泛的操作范围、更稳健的组适当条件和更改的相关信息类别,改进后的方法可能提供几个优点,包括:
了解分析方法的属性,这些属性对程序的执行至关重要。
改进对分析方法的控制,以实现更可靠的性能。
通过使用更多的分析方法知识,促成预防措施并促进持续改进。
减少整个分析过程生命周期的工作量。
Q14还描述了开发多变量和实时放行测试程序(RTRT)的注意事项。提供了支持分析程序变更管理的原则,这些原则基于风险管理、对分析程序的全面理解以及对性能特征的预定标准的遵守。另外,Q14还提供了分析方法开发的提交注意事项和通用技术文件(CTD)格式的相关生命周期信息。
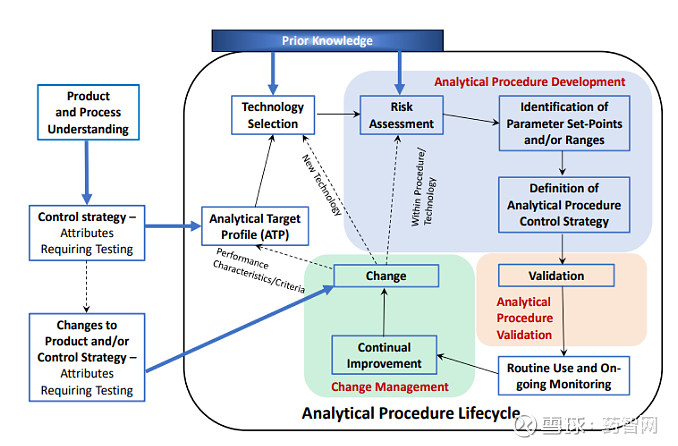
Q14分析方法生命周期
图片来源:ICHQ14
Q14同时还有3个附录文件:附录A-分析方法生命周期,并具体分享两个案例(小分子原料药(DS)中作为特定工艺相关杂质的立体异构体的测量;抗TNF-α单克隆抗体效力的测量),附录B-MODR验证策略,附录C-多变量模型生命周期组成的示例。
如此看来,Q14有望改善行业和监管机构之间的监管沟通,实现更有效的、基于科学和风险的审批,并促进分析方法的审批后变更管理。同时,由于方法开发和验证之间存在密切关系,Q14建议对过程和从中获得的知识进行控制,以获得关于分析程序预期目的的信息,以及要验证的相关特征和标准的性能。下图显示了在开发Q14中提出的分析方法时如何产生知识,从而帮助设计验证研究。

验证研究的设计和评价
图片来源:ICHQ2(R2)
Q2(R2)分析方法验证指南
Q2(R1)现行版发布于2005年11月,当时,它将两个指南Q2A(包含所需验证参数的分析方法)和Q2B(方法学指南)合并,但其起草时间是在色谱技术盛行的1995年。这么多年过去,显然其已无法满足当下需求,比如现代分析方法的缺失,如近红外光谱(NIR)或拉曼光谱。
众所周知,分析方法验证的目标是证明该方法适合其预期目的。因此,数据和结果必须足够可靠才能做出决策。但是由于缺乏对这些分析方法的指导,企业提交的材料中对这些分析方法的验证数据不充分,从而导致重复的信息要求和答复,这可能会延迟申请的批准。对于依赖多变量模型的分析方法来说,这种情况尤其明显,而NIR或拉曼光谱通常用于使用多变量分析方法的过程控制和实时释放测试(RTRT)。因此,ICHQ2(R2)专门针对现代分析程序的验证,包括讨论验证中的统计方面以及程序的常见验证特征,如NIR、核磁共振波谱(NMR),以及联用技术,例如CE-MS、CE-ICP-MS、LC-NMR、GC-MS、LC-MS。
在目前发布的草案中,Q2(R2)对作为提交给ICH成员监管机构的注册申请的一部分的分析程序的验证期间需要考虑的因素进行了讨论,并就如何得出和评估每个分析程序的各种验证测试提供指导和建议。作为术语及其定义的集合,弥补ICH成员监管机构的各种汇编和文件之间经常存在的差异,提供了在监管文件中应提交的数据的说明。
具体来看,Q2(R2)框架与R1保持一致,但每个章节的内容都做了更新。另外,新增加了以下章节:3.1(分析方法的生命周期内的验证)、3.3(证明方法对稳定性的可指示性)、3.4(对多元分析方法的考虑),以及两个附录。比如调整了验证项目的选择,从之前的验证项目包括专属性、精密度、线性、准确性、范围、检测限、定量限等重新规划为四大块,即专属性、工作范围、准确性、精密度。并在附录1中,用图示的形式,具体给出了以检验目的为基础的验证项目要求。
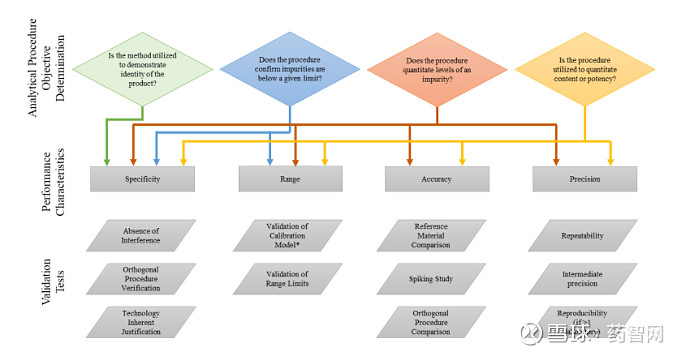
根据分析方法的目的选择验证试验
图片来源:ICHQ2(R2)
另外,Q2(R2)附件2则提供了分析技术的说明性示例,解答了一些现行的ICHQ2的过程中颇有争议却一直没有明确的问题,比如峰面积归一法、或者以主成分的稀释溶液作为自身对照的峰面积归一法的杂质检测,到底按定量法来验证,还是定性法?以及如何验证?
总的来说,Q2(R2)继续提供分析方法验证的一般框架,并扩展覆盖当前新技术(如生物产品或多变量分析方法)。使用增强的分析方法开发和验证方法促进资源高效的药物开发以及提交过程或促进CMC批准后的更改。
小结
ICHQ14和ICHQ2(R2)代表了分析方法整个生命周期的统一的科学和技术原则,即从分析方法的开发到验证,并考虑到今后会进行的变更,共同描述了在评估医药产品和医疗器械(组合产品)质量的分析方法的生命周期中提出的开发和验证活动,有望扭转仿制药主导下的生产工艺高于分析方法的畸形局面,实现两条腿走路。
药物的开发与验证在整个药物生命周期中至关重要,即是关键点,也是难点,原料药尤其如此。且新药开发不同阶段,分析方法的要求不一样,怎样能快速开发一个合适的分析方法,是我们质量研究人一直在思考的问题。
参考资料
[1]Q2(R2)Draft Guideline
[2]Q14Draft Guideline