来源:先声药业、上海经信、药时代、药研网
编辑:子非鱼
2023年1月16日,先声药业宣布:与中国科学院上海药物研究所、武汉病毒研究所联合开发的创新药先诺欣®(先诺特韦片/利托那韦片组合包装)新药上市申请(NDA)获国家药品监督管理局(NMPA)以药品特别审批程序受理,拟用于治疗轻至中度新型冠状病毒感染(COVID-19)成年患者。
先诺欣®是一款口服小分子抗新冠病毒创新药,是先诺特韦片与利托那韦片的组合包装药物,其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。在临床前动物试验中,先诺欣®显示出高效、广谱抗新冠病毒活性,未发现遗传学毒性。
2021年11月17日,先声药业与中国科学院上海药物研究所、武汉病毒研究所订立技术转让合同,获得先诺特韦在全球开发、生产及商业化的独家权利。
2022年3月28日及5月13日,先诺欣®分别获国家药品监督管理局签发的2项药物临床试验批准通知书。
2022年8月19日,一项评估先诺欣®治疗轻中度COVID-19成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的Ⅱ/Ⅲ期临床研究达成首例患者入组,2022年12月16日完成全部1208例患者入组。
先诺欣®注册临床研究由中国医学科学院、国家呼吸医学中心王辰院士、中日友好医院曹彬教授牵头,复旦大学附属中山医院樊嘉院士、复旦大学附属中山医院感染病科主任胡必杰教授共同指导完成,是第一个针对中国人群感染奥密克戎毒株的大样本临床试验,也是国内外第一个针对奥密克戎毒株感染者达成“以咳嗽、鼻塞流涕、咽痛、发热、头痛、肌肉或全身痛等11个症状持续恢复”为主要终点的III期注册临床研究。本项注册临床研究共纳入全国20个省市自治区43家临床参研中心,在深圳第三人民医院院长卢洪洲教授、武汉金银潭医院院长黄朝林教授等多位临床专家的大力支持下,快速而高质量完成了全部1208例患者临床试验。
关于本项注册临床研究有效性、安全性的详细数据将在产品批准上市后公布或公开发表。本项目I期临床试验在山东千佛山医院赵维教授指导下完成。
目前,国内治疗新冠的小分子药物有辉瑞的Paxlovid、默沙东的莫诺拉韦,另有河南真实生物的阿兹夫定。
辉瑞的Paxlovid是全球首款针对新冠病毒的口服3CL蛋白酶抑制剂,是由奈玛特韦和利托那韦合用的一种治疗方法。Paxlovid在国内售价为2300元/盒,之后在某些省份下调至1890元/盒。刚刚在国家医保谈判中未能进入医保目录,但医保临时支付至3月31日。
辉瑞在国内选择与中国医药健康产业股份有限公司(简称中国医药,股票代码:600056,注意,不是国药集团)合作,由中国医药负责该药物在中国大陆市场的进口与分销业务。
此外,辉瑞还与华海药业签订生产供应协议,由华海负责为辉瑞在中国大陆市场销售的Paxlovid提供制剂委托生产服务。

默沙东M药莫诺拉韦已经上市销售,与国药集团合作
默沙东的莫诺拉韦于2022年12月30日在国内上市,没有参与国家医保谈判。默沙东与国药集团展开合作,将莫诺拉韦在中国境内的经销权和独家进口权授予国药集团。1月13日,莫诺拉韦正式在国内销售。
国产的新冠口服药阿兹夫定片挂网价为270元/瓶,在互联网网售平台,其价格为330元/瓶。阿兹夫定的生产商真实生物与复星医药展开合作,双方将联合开发并由复星医药控股子公司复星医药产业独家商业化阿兹夫定。

平安盐野义Ensitrelvir已向CDE提交申请,上海医药独家进口和经销
除此之外,平安盐野义Ensitrelvir已向CDE提交新药上市许可申请的阶段,2022年12月23日,上海医药发布公告称,平安盐野义将把其母公司日本盐野义制药株式会社研发并在日本上市的抗新冠病毒口服药物Ensitrelvir片的进口品在中国大陆的独家进口权和经销权授予上海医药。
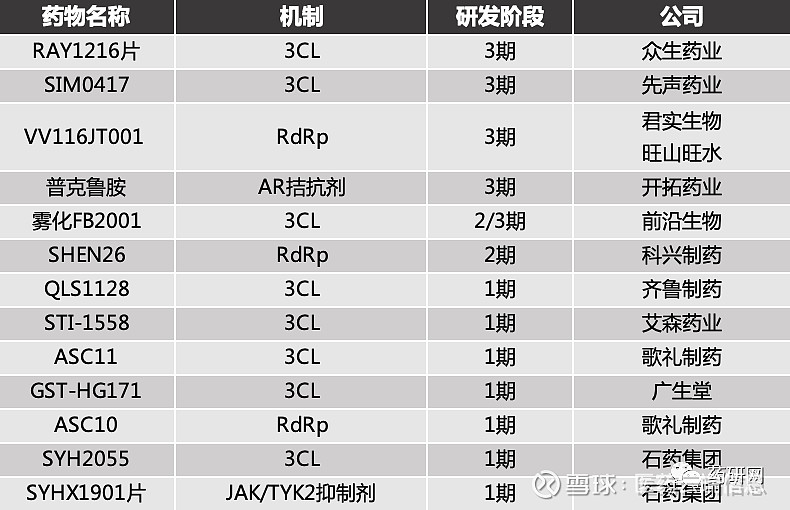
君实生物VV116开始同情用药,正积极申请紧急授权使用
君实生物的新冠药VV116目前处于临床3期阶段,近期,VV116连续两次上登上《新英格兰医学杂志》(NEJM),该杂志在线发表了VV116“头对头辉瑞Paxlovid”3期临床试验结果。
结果表明:对于有高危因素的轻中度COVID-19成人患者,在至持续临床康复时间方面,VV116非劣于PAXLOVID,且不良事件更少。
1月9日,VV116已于昨日开始在上海同情用药,由有关地方组织统一安排,将在上海7家医院开始以同情用药的形式用于治疗新冠病人。
这7家医院包括:上海瑞金、曙光、华山、仁济、上海公卫中心、新华医院和浦东医院。另据消息灵通人士透露,公司尽全力与监管层面沟通,以求获得紧急授权使用。
腾盛博药安巴韦单抗/罗米司韦单抗国产中和抗体联合治疗药物
由腾盛博药、深圳第三人民医院、清华大学合作研发的安巴韦单抗/罗米司韦单抗联合疗法是中国首个自主知识产权新观病毒中和抗体联合治疗药物。
其于2021年12月8日获得NMPA批准,于2022年3月纳入《新型冠状病毒肺炎诊疗方案(试行第九版)》。腾盛博药表示,该药物在预防感染具有潜在有效性,并且已经在美启动了该药物用于暴露前预防的临床前研究。
目前安巴韦单抗和罗米司韦单抗联合疗法在中国大陆定价为每人份1万元左右。
阿斯利康替沙格韦单抗/西加韦单抗(Evusheld)经乐城引入国内,获批后由通用技术进口及分销
由阿斯利康研发的Evusheld曾是全球唯一一款可以用于新冠暴露前预防的中和抗体药物。Evusheld由替沙格韦单抗与西加韦单抗组合而成,与安巴韦单抗/罗米司韦单抗相似,同样通过阻断新冠S蛋白与ACE2受体结合对抗新冠感染。
2022年6月,Evusheld在海南博鳌乐城国际医疗旅游先行区通过特殊进口审批,定价13300元/人。
1 月 11 日,阿斯利康与通用技术中国医药就 Evusheld 签属战略合作框架协议,在该药物获得在中国大陆地区的附条件批准上市或紧急使用授权 (EUA) 后,双方将签订进口和分销协议,通用技术中国医药将在协议期内负责 Evusheld 在中国大陆市场的进口和分销业务的开展。