编辑:安诺影
根据医药云端工作室统计,本周(2019年12月29日-2020年1月4日),新增7个品种涉及8个品规通过一致性评价,具体如下表:
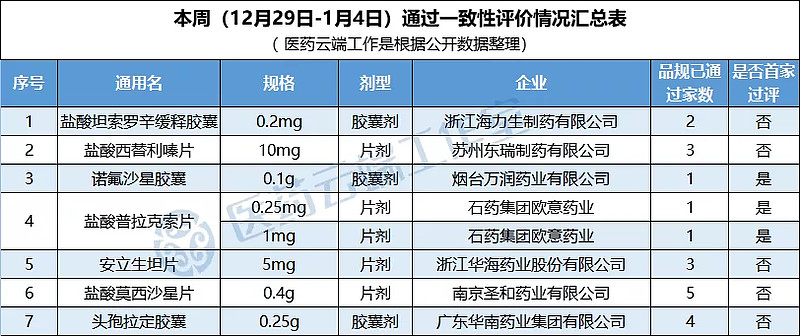
浙江海力生制药:盐酸坦索罗辛缓释胶囊(0.2mg)通过一致性评价
2019年12月31日,山西仟源医药集团公告称其子公司浙江海力生制药有限公司的“盐酸坦索罗辛缓释胶囊”(0.2mg)通过一致性评价。
盐酸坦索罗辛缓释胶囊由山之内制药株式会社开发,最早于1993年在日本获批上市销售,商品名为Harnal(哈乐)。该药品主要用于治疗成人前列腺增生症引起的排尿障碍,是目前治疗该疾病的一线主要用药,现已列入国家医保目录和国家基本药物目录。
经查询IMS数据库,2017年盐酸坦索罗辛缓释胶囊全球销售额约为5.7亿美元、中国销售额约为9083.7万美元。
华南药业:头孢拉定胶囊(0.25g)通过一致性评价
2019年12月31日,广东众生药业全资子公司广东华南药业集团有限公司的头孢拉定胶囊通过一致性评价。头孢拉定胶囊是国家基本药物,国家医保目录甲类品种。
头孢拉定胶囊适用于敏感菌所致的急性咽炎、扁桃体炎、中耳炎、支气管炎和肺炎等呼吸道感染、 泌尿生殖道感染及皮肤软组织感染等。头孢拉定作为第一代头孢菌素类抗生素, 因其最低抑菌浓度(MIC)及(或)药物血清浓维持在 MIC 以上时间较头孢氨 苄、头孢克洛及头孢磺啶均佳,且蛋白结合率较低,对 β-内酰胺酶较稳定,肾毒 性较低,对多数革兰氏阳性菌和部分革兰氏阴性菌都有效。由于其抗菌谱较广, 不良反应较轻,价格适中和使用方便,近 20 年来,在我国临床应用甚为广泛, 已成为临床抗感染的一线用药。
查阅米内网中国城市公立医院化学药终端竞争格局数据库显示,头孢拉定胶囊 2016 至 2018 年销售额分别为人民币 33,892 万元, 33,839 万元,32,240 万元。
圣和药业“盐酸莫西沙星片”获批上市,视同过评
2019年12月31日,南京圣和药业股份有限公司官微宣布,其申报的新化药4类仿制药“盐酸莫西沙星片”(受理号:CYHS1700134)在国内的上市申请审批状态变更为「审批完毕-待制证」,审评结论为:批准生产。
该药品主要用于治疗成人敏感细菌所引起的:急性细菌性鼻窦炎、慢性支气管炎、社区获得性肺炎、皮肤组织感染、腹腔内感染和轻至中度盆腔炎等。
截止目前,除圣和药业外,该药品还有有广东东阳光药业有限公司、四川国为制药有限公司、南京优科制药有限公司、北京福元医药股份有限公司4家企业通过一致性评价。
东瑞制药:盐酸西替利嗪片(10mg)通过一致性评价
2020年1月2日,东瑞制药附属公司苏州东瑞制药有限公司的抗过敏药物“盐酸西替利嗪片”10mg(商品名「西可韦」)通过一致性评价。
盐酸西替利嗪是一种临床常用的抗过敏药物,具有选择性拮抗组胺H1受体的作用。对症治疗下述疾病的过敏性相关症状,如季节性鼻炎、常年性过敏性鼻炎、过敏性结膜炎及过敏引起的瘙痒和蕁麻疹。
据公开数据显示,2018年,盐酸西替利嗪制剂全球销售额约为8.84亿美元,国内医院销售额近1.24亿元。
石药集团“盐酸普拉克索片”全国首家通过一致性评价
1月2日,石药集团发布公告,其附属公司石药集团欧意药业有限公司开发的新 4 类仿制药盐酸普拉克索片(0.25mg、1.0mg)已获国家药监局颁发药品注册批件,为国内该品种首家视同过评以及第二家获批仿制药。
盐酸普拉克索为神经系统疾病药物,适用于治疗:
1、成人特发性帕金森病,在整个疾病过程中(包括疾病后期),当左旋多巴的疗效逐渐减弱或者出现变化和波动时,都可单独使用(无左旋多巴)或与左旋多巴联用;
2、中度至重度特发性不宁腿综合症。盐酸普拉克索原研厂家为勃林格殷格翰。
Insight 数据库显示,浙江京新药业的该药品在2018年8月份首仿获批,但是是按照6类获批,上市后需要做一致性评价,目前已经递交一致性评价补充申请。石药集团盐酸普拉克索片为国内第二家获批上市,但是首家通过一致性评价。
据米内网数据显示,2018年中国公立医疗机构终端普拉克索的销售额为6.88亿元。
万润药业“诺氟沙星胶囊”全国首家通过一致性评价
2020年1月3日,中节能万润股份有限公司的全资子公司烟台万润药业生产的诺氟沙星胶囊(0.1g)全国首家通过一致性评价。
诺氟沙星属于喹诺酮类抗菌素,适用于敏感菌所致的尿路感染、淋病、前列 腺炎、肠道感染和伤寒及其他沙门菌感染。
诺氟沙星胶囊于1987年在国内上市, 目前国内共有691个诺氟沙星胶囊的生产批文。该药品属于国家医保目录品种(2019 年版)和国家基药目录(2018年版)。
华海“安立生坦片”获批上市,视同过评
1月3日,华海药业发布公告称安立生坦片(5mg)获批上市,该药按4类注册申报,视同通过一致性评价。
安立生坦片主要用于治疗有(世界卫生组织)WHOⅡ级或Ⅲ级症状的肺动脉高压患者(WHO 组 1),用以改善运动能力和延缓临床恶化。
安立生坦片由美国 Myogen公司开发,2007年6月在美国批准上市,2010年该产品在中国批准上市。
根据公告数据,2018 年安立生坦片全球市场销售额约4.6 亿美元;2019 年前三季度安立生坦片国内等级医院销售额约人民币 842 万 元。
截至目前,华海药业在安立生坦片研发项目上已投入研发费用约人民币536 万元。
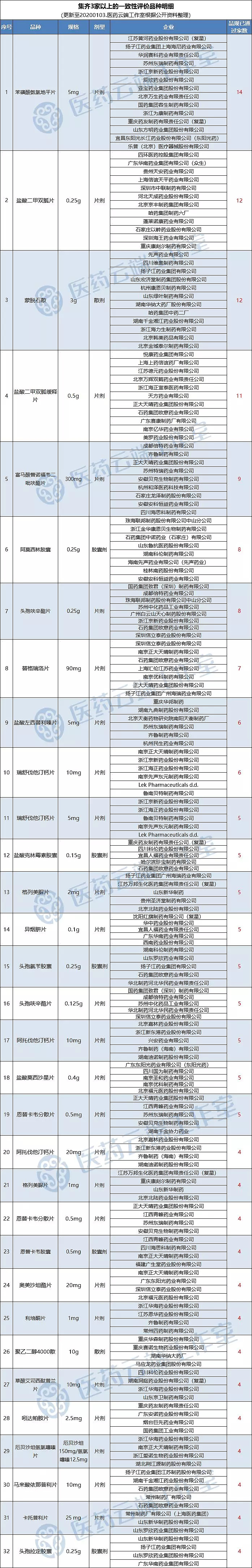
全国最新过评数据通报:目前已有533个品规通过一致性评价,53个品种集齐三家以上(含三家)过评
据医药云端工作室不完全统计,截止目前,共有533个品规通过一致性评价。其中53个品种已集齐三家以上过评:
苯磺酸氨氯地平片(5mg)已有14个厂家通过;
盐酸二甲双胍片(0.25g)、蒙脱石散(3g)已有12个厂家通过;
盐酸二甲双胍缓释片(0.5g)已有11个厂家通过;
富马酸替诺福韦二吡呋酯片(300mg)已有9个厂家通过;
阿莫西林胶囊(0.25g)、头孢呋辛酯片(0.25g)已有8个厂家通过;
替格瑞洛片(90mg)已有7个厂家通过;
瑞舒伐他汀钙片(10mg)、盐酸左西替利嗪片(5mg)已有6个厂家通过;
瑞舒伐他汀钙片(5mg)、盐酸克林霉素胶囊(0.15g)、异烟肼片(0.1g)、头孢氨苄胶囊(0.25g)、头孢呋辛酯片(0.125g)、格列美脲片(2mg)、阿托伐他汀钙片(10mg)、盐酸莫西沙星片(0.4g)、恩替卡韦分散片(0.5g)已有5个厂家通过;
阿托伐他汀钙片(20mg)、格列美脲片(1mg)、恩替卡韦胶囊(0.5mg)、恩替卡韦分散片(0.5mg)、奥美沙坦酯片(20mg)、利培酮片(1mg)、聚乙二醇4000散(10mg)、草酸艾司西酞普兰片(10mg)、吲达帕胺片(2.5mg)、厄贝沙坦氢氯噻嗪片(厄贝沙坦150mg/氢氯噻嗪12.5mg)、马来酸依那普利片(10mg)、卡托普利片(25 mg)、头孢拉定胶囊(0.25g)13个品规已有4个厂家过评。