$康诺亚-B(02162)$做三期临床特应性皮炎临床,先声康乃德失去领先优势。
SIM0718在成人及青少年严重不可控的特应性皮炎患者中启动三期临床试验NCT06477835,该临床预计将于2024年10月启动,计划入组人数为250例。
先声前后启动IL-4R抗体的特应性皮炎和哮喘三期临床

根据UmabsDB数据库的记录,先声药业在clinical trials网站上,登记了一项IL-4R抗体药物SIM0718,在成人及青少年严重不可控的哮喘患者中启动三期临床试验NCT06488755,该临床预计将于2024年7月启动,计划入组人数为418例。

两周之前,先声药业才刚刚在clinical trials网站上,登记了SIM0718在成人及青少年严重不可控的特应性皮炎患者中启动三期临床试验NCT06477835,该临床预计将于2024年10月启动,计划入组人数为250例。

SIM0718是一款IL-4R抗体药物,2023年11月21日,先声药业宣布与康乃德生物签订独家许可和合作协议,以特许权使用费加上1.5亿元人民币的预付款,最高可达8.75亿元人民币里程碑,引进后者开发的IL-4Rα单抗rademikibart在大中华区开发和商业化权益(创始人离场,康乃德更换管理层) 。
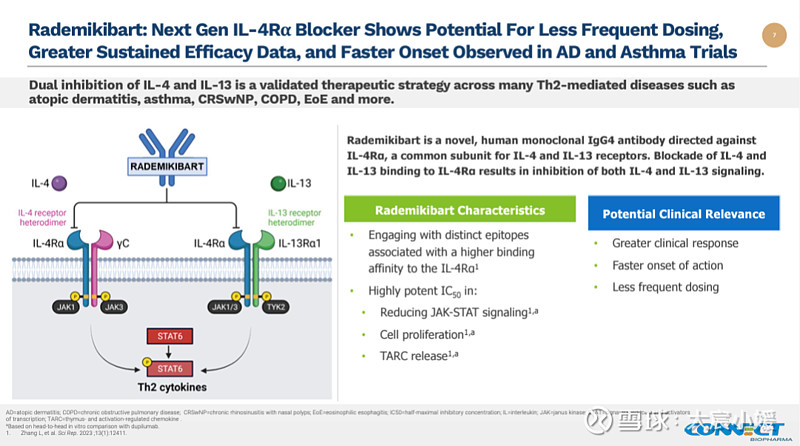
交易当天出现戏剧性一幕,康乃德公布了rademikibart治疗中至重度特应性皮炎(AD)的中国关键性2期临床试验的长期积极数据,第 52 周的积极结果表明rademikibart针对AD每四周一次(Q4W)给药方案的潜力,但为期16周的第一阶段研究结果并没有体现对Dupilumab的优效,股票应声下跌40%(Biotech式的宿命)。
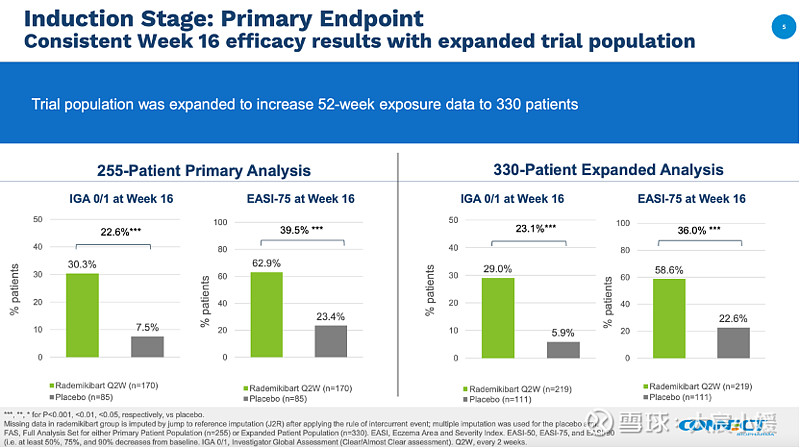
根据彼时的公开协议,康乃德将完成rademikibart在中国正在进行的所有特应性皮炎(AD)临床试验和相关分析后,该药物有望于 2024 年第一季度末在中国提交NDA,但是直到今日都没有递交上市申请。
值得注意的是康乃德的这项关键是临床是一项二期研究,入组病人数量也较为有限,此前康诺亚的il-4R抗体也因为临床终点时长不够的情况撤回重新提交上市申请,不知道是否是基于这项目二期临床数据不足影响了其上市申请计划。
另一方面根据协议,先声药业将获得授权拥有在大中华区(包括中国大陆、香港、澳门和台湾)开发、生产和商业化rademikibart所有适应症的独家权利,康乃德保留在其余市场的权利。先声药业将负责rademikibart在中国的NDA以及rademikibart在大中华区其他适应症未来全部的临床研究和支出。
显然在康乃德的创始人离场,管理层出现巨变后(网页链接{创始人离场后,Panacea Venture加速入局}),接盘后的先声药业快速推进两项三期临床,以加快rademikibart的商业化进程。