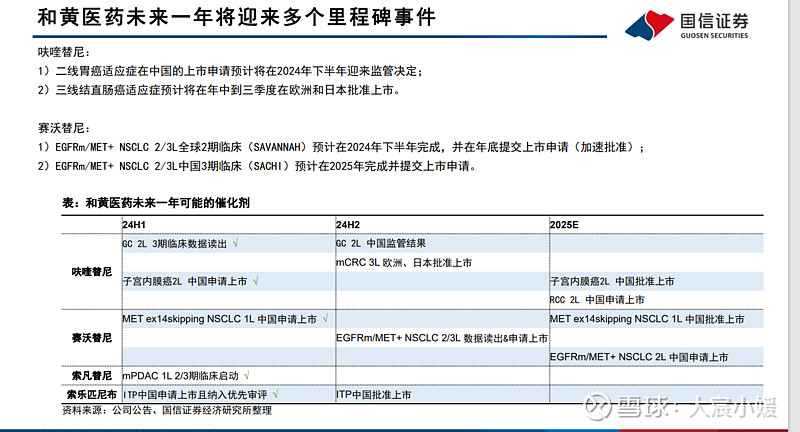
$和黄医药(00013)$ 和黄医药(00013.HK) 小分子创新药为核心,商业化和出海持续兑现 公司研究 · 深度报告 医药生物 · 生物制药 投资评级:买入(首次评级
国信证券。
2024-5-24
和黄医药:
以小分子为核心的创新药公司。和黄医药是一家处于商业化阶段的创新型生物医药公司,专注于发现、开发及商业化治疗癌症及免疫性 疾病的靶向疗法及免疫疗法;核心产品呋喹替尼、赛沃替尼和索凡替尼等均已在中国获批上市,且呋喹替尼已经在美国获批上市并由合作伙伴成功开 启商业化。
公司的现有产品拥有较大的拓展潜力,管线中的产品未来上市将为公司增长提供新的增量。 呋喹替尼:成功出海的小分子创新药。呋喹替尼是一种选择性的口服VEGFR-1/2/3抑制剂,在中国和美国均已获批上市;凭借优秀的临床数据,在中 国三线结直肠癌市场占据了领先地位。呋喹替尼在美国上市初期就迅速放量,今年有望在欧洲和日本获批上市,持续开拓全球市场。呋喹替尼的第二 个适应症(二线胃癌)有望于今年下半年在中国获批上市,大幅拓展可覆盖的患者人群。 赛沃替尼:与奥希替尼联用空间广阔。
赛沃替尼是一种强效、高选择性的口服MET酪氨酸激酶抑制剂,在中国获批用于二线治疗MET外显子14跳跃突 变的非小细胞肺癌患者。此外,赛沃替尼和奥希替尼正在开展多项联用的临床试验,包括在中国和全球范围内开展的1L和2/3L EGFR突变且MET高度异 常的非小细胞肺癌的关键临床,有望拓展广阔的EGFR突变肺癌市场。
索凡替尼挑战胰腺癌、索乐匹尼布申请上市。索凡替尼是一种多靶点的小分子TKI,目前获批用于神经内分泌瘤的治疗;索凡替尼与PD-1单抗联用, 在一线胰腺癌中取得了优秀的早期临床数据,并且已经开启的2/3期临床。索乐匹尼布是一种潜在同类最佳的Syk抑制剂,治疗成人免疫性血小板减少 症(ITP)的适应症已经申报上市,有望在今年批准在中国上市。
商业化和出海持续兑现,首次覆盖,给予“买入”评级。公司在小分子的研发和商业化能力均已得到验证,且在全球范围内与多个跨国药企达成合 作协议,除呋喹替尼之外,其他产品也有授权出海的潜力。
呋喹替尼、赛沃替尼、索凡替尼的销售增长将成为未来三年公司业绩的主要推动力,公司 有望在2025年实现盈亏平衡。我们预计公司24~26年的营收分别为7.05/9.01/10.44亿美元,同比增长-16%/28%/16%,归母净利润-0.86/0.41/1.04亿 美元,根据绝对估值法,我们测算和黄医药合理价值区间为38.0~41.1港元/股,相比当前股价有25~35%的上涨空间,首次覆盖,给予“买入”评级
截至2023年报,和黄医药的第一大股东为长江和记实业(持股38.2%),另有多位管理层持股。公司的核心业务为肿瘤/免疫药物的研发和 销售。其他业务中,上海和黄药业主要经营中药的生产和销售业务,由和黄医药和上海医药分别持股50%,是公司的联营子公司;国药和 黄主要经营医药流通和分销业务,由和黄医药持股51%,国药控股持股49%,是公司的控股子公司
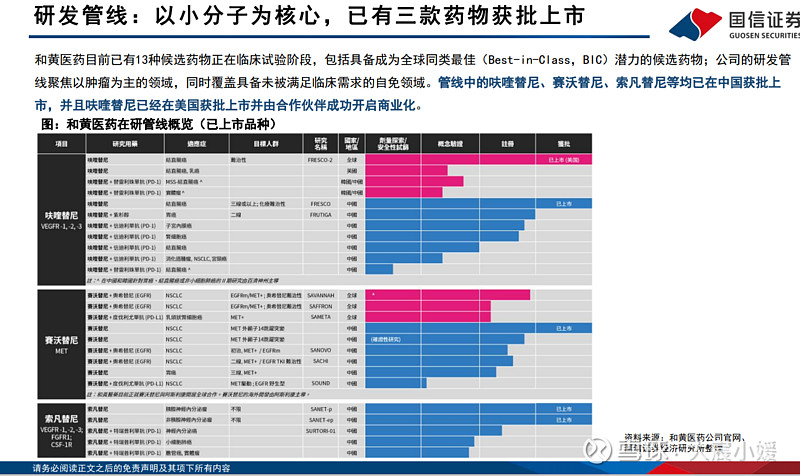
呋喹替尼(Fruquintinib,商品名:爱优特/FRUZAQLA)是一种选择性的口服VEGFR-1/2/3抑制剂。VEGFR抑制剂在抑制肿瘤的血管生成中 起到关键的作用。呋喹替尼被设计位拥有更高的激酶选择性,旨在降低脱靶激酶活性,从而实现更高的药物暴露、对靶点的持续覆盖以及 当潜在作为联合疗法时拥有更高的灵活度。呋喹替尼在中国(2018年9月)和美国(2023年11月)均已获批了三线以上结直肠癌(3L mCRC) 的适应症。呋喹替尼在中国由和黄医药的团队进行销售,在海外的权益已授权给武田,并由合作伙伴进行销售。 在研适应症中,呋喹替尼联合化疗二线治疗胃癌(GC 2L)的适应症已在2023年向NMPA提交上市申请,有望在今年下半年获批上市;呋喹 替尼联合信迪利单抗二线治疗MSS/pMMR的子宫内膜癌的适应症也已经在2024年上半年提交上市申请。此外,呋喹替尼三线治疗结直肠癌的 适应症也已经向欧洲和日本递交上市申请,预计将在今年获批上市。
赛沃替尼(savolitinib,商品名:沃瑞沙)是一种强效、高选择性的口服MET酪氨酸激酶抑制剂(MET-TKI),在晚期实体瘤中表现出临 床活性。赛沃替尼可以阻断因基因突变(例如外显子14跳跃突变或其他点突变)、基因扩增或蛋白质过表达而导致的MET受体酪氨酸激酶 信号通路的异常激活。 赛沃替尼于2021年6月获中国药监局附条件批准上市,用于治疗含铂化疗进展或不耐受标准含铂化疗的(二线)MET外显子14跳跃突变 (ex14 skipping)的非小细胞肺癌患者,是中国首个获批的选择性MET抑制剂。此外,赛沃替尼和奥希替尼正在开展多项联用的临床试验, 包括在中国和全球范围内开展的2L EGFRm/MET+ NSCLC和1L EGFRm/MET+ NSCLC的关键临床试验,有望拓展广阔的EGFR突变NSCLC市场
索凡替尼联合PD1单抗挑战胰腺癌一线治疗 35 全球每年估计有超过50万人被诊断患有胰腺癌,在2022年导致约46.7万人死亡,平均5年存活率低于10%。在中国,每年估计有11.9万人被 诊断患有胰腺癌,在2022年导致约10.6万人死亡。转移性胰腺癌患者的一线标准治疗还是化疗,预后较差。 索凡替尼在一线胰腺癌的早期数据优秀。索凡替尼联合PD1单抗(特瑞普利单抗)和化疗一线治疗胰腺癌的临床在今年的ASCO GI上更新了 临床数据,试验共入组了49名患者,其中ph1b入组了6名,索凡替尼的RP2D=200mg。在48名可评估的患者中(实验组28名,化疗对照组20 名),ORR=53.6% vs 15.0%,mOS=15.57 vs 8.63 mo,mPFS=9.17 vs 6.3 mo,中位随访时间13.7个月。实验组最常见的不良反应(Aes) 为中性粒细胞计数减少(57.1%)、肝毒性(42.9%)、神经疾病(39.3%);免疫相关的不良反应(irAEs)在5名患者中被观察到,包括4 名患者有3级以上的肝毒性,1名患者有2级的肠炎。 索凡替尼在胰腺癌中开启2/3期临床。2024年5月14日,和黄医药公告披露,公司与恒瑞医药达成合作,并启动索凡替尼联合卡瑞利珠单抗、 白蛋白紫杉醇和吉西他滨治疗一线转移性胰腺导管腺癌(1L mPDAC)的2/3期临床,首例患者已在2024年5月8日完成入组。试验以白紫和 吉西他滨为对照组,在2/3期阶段预计入组500名患者,主要终点为OS,关键次要终点为ORR、PFS、DCR等。