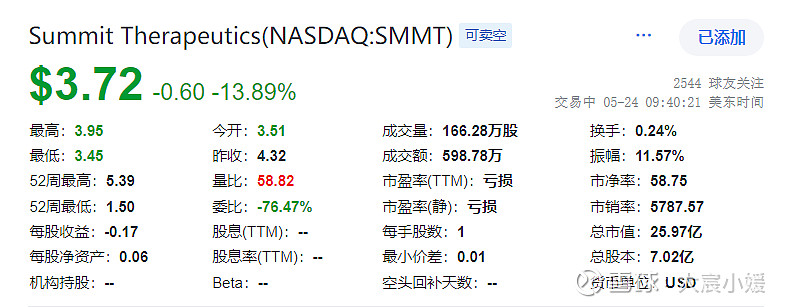
$康方生物(09926)$股价表现正常
2024年5月24日,负责为临床候选药物提供上市授权的中国监管机构国家药品监督管理局(NMPA)已批准伊沃昔单抗联合化疗用于表皮生长因子受体(EGFR)突变、局部晚期或转移性癌症(NSCLC)患者,这些患者在接受EGFR酪氨酸激酶抑制剂(TKI)治疗后取得进展。
这是任何监管机构首次批准伊沃内斯西马。科特迪瓦西马的批准是基于名为HARMONi-A(AK112-301)的试验,这是一项在中国进行的单区域III期临床试验,比较了在上述环境中科特迪瓦西马加化疗与安慰剂加化疗。试验由我们的合作伙伴股份有限公司(Akeso)赞助。本试验的数据由Akeso生成并分析。该数据计划在2024年5月31日(星期五)CT下午4:57举行的2024年美国临床肿瘤学会(ASCO)年会上发布。
2024年5月23日,ASCO发布了摘要,供年会期间的演讲使用。这些摘要中包括了与HARMONi-A相关的最新数据。值得注意的是,独立放射学审查委员会(IRRC)认为,接受伊沃西单抗联合化疗的患者的中位无进展生存期(PFS)为7.06个月(95%CI:5.85-8.74),而单独接受化疗的患者为4.80个月(95%CI:4.21–5.55)(风险比:0.46;95%CI:0.34–0.62)。
61.5%接受伊沃西单抗联合化疗的患者发生≥3级治疗突发不良事件(TEAE),而接受化疗的患者为49.1%;最常见的≥3级TEAE是化疗相关的不良事件。
ASCO年会期间预计将提供其他数据和背景,包括但不限于反应率、稳定疾病率、无进展生存率、总生存率和安全性。
摘要可在此处找到(摘要8508):网页链接
Ivonescimab未经Summit许可区域(包括美国、加拿大、欧洲和日本)的任何监管机构批准。
NMPA在中国的批准并没有改变Summit目前的临床开发计划。Summit继续招募以下适应症的患者参加其两项多区域III期临床试验:
a.ivonescimab联合化疗治疗EGFR突变、局部晚期或转移性非鳞状NSCLC患者,这些患者在第三代EGFR-TKI(“HARMONi”)治疗后取得进展;和
b.ivonescimab联合化疗治疗一线转移性鳞状NSCLC患者(“HARMONi-3”)。
NMPA的批准不会影响我们正在进行的HARMONi和HARMONi-3试验的开发,也不会改变ivonescimab在美国或Summit的其他许可地区的试验过程的时间或要求,或批准的可能性。
笔记